3.5 Методы определения чувствительности микроорганизмов к антимикробным препаратам и интерпретация результатов
Основной целью оценки чувствительности микроорганизмов к антибиотикам является прогнозирование их эффективности при лечении инфекций у конкретных пациентов. Определение чувствительности также проводят с целью эпидемиологического наблюдения за распространением резистентности среди микроорганизмов и в процессе изучения новых препаратов.
Использование унифицированных методов определения чувствительности и подходов к интерпретации результатов является необходимым условием не только для правильного выбора АМТ у конкретного пациента, но и для формирования эффективной системы эпидемиологического наблюдения за антибиотикорезистентностью.
3.5.1 Методы определения чувствительности к антимикробным препаратам
Основным параметром, характеризующим взаимоотношения между микроорганизмом и антибиотиком, является величина минимальной подавляющей концентрации (МПК) препарата. МПК – это минимальная концентрация антибиотика, подавляющая видимый рост микроорганизма при его культивировании in vitro в стандартных условиях [32] . Относительно значений МПК, установленных референтным методом микроразведений, «калибруются» как наиболее распространенный в рутинной практике диско-диффузионный метод (ДДМ), так и различные коммерческие методы определения чувствительности [33] .
Результаты оценки чувствительности бактерий, полученные с помощью референтного метода, используют для обоснования микробиологических и клинических критериев оценки чувствительности [34] .
3.5.1.1 Метод последовательных разведений

Основным методом определения МПК является метод последовательных разведений. Для определения МПК заданные концентрации антибиотика (чаще всего с 2-кратным шагом) вносят в питательную среду, которую затем засевают культурой исследуемого микроорганизма и после инкубации оценивают наличие или отсутствие видимого роста в присутствии различных концентраций антибиотика. Известны два основных варианта постановки метода последовательных разведений: в агаре и в бульоне. Метод разведений в агаре в настоящее время используется в основном для определения чувствительности к отдельным антибиотикам, в частности, к фосфомицину. Метод последовательных разведений в бульоне, в свою очередь, может выполняться в макрои микро-варианте (в объеме ≤ 0,2 мл).
Метод последовательных микроразведений в бульоне является референтным методом определения МПК и регламентируется международным стандартом ISO 20776-1:2019 («Clinical laboratory testing and in vitro diagnostic test systems – Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices – Part 1: Reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases») [35] . В Российской Федерации Приказом Федерального агентства по техническому регулированию и метрологии Российской Федерации от 23 ноября 2010 г. № 499-ст [36] утвержден и введен в действие Национальный Стандарт ГОСТ Р ИСО 20776-1-2010, идентичный международному стандарту ISO 20776-1 (в редакции 2006 г.).
Преимущества:
- Количественный (МПК – прямая количественная характеристика in vitro активности АМП);
- Стандартизированный;
- Гибкий (набор антибиотиков, широкий диапазон концентраций);
- Высокая воспроизводимость результатов;
- Возможность исследования чувствительности у большинства клинически значимых бактерий.
Ограничения:
- Трудоемкость;
- Высокие требования к квалификации и опыту персонала;
- Высокая стоимость (субстанции антибиотиков).
В настоящее время для практических лабораторий доступен целый ряд суррогатных методов определения МПК с использованием коммерческих расходных материалов, например: коммерческие варианты метода микроразведений в бульоне (автоматизированные и без автоматизации).
Преимущества:
- Меньше требований к контролю качества определения чувствительности в лаборатории (но не исключает его полностью!) при соблюдении условий транспортировки и хранения;
- При наличии программного обеспечения – автоматизированный учет результатов;
- Снижение трудозатрат;
- Не требуют высокой квалификации персонала.
Ограничения:
- Невозможность определения чувствительности всех клинически значимых видов бактерий;
- Фиксированный набор и ограниченный диапазон разведений антибиотиков;
- Относительно высокая стоимость.
3.5.1.2 Метод градиентной диффузии
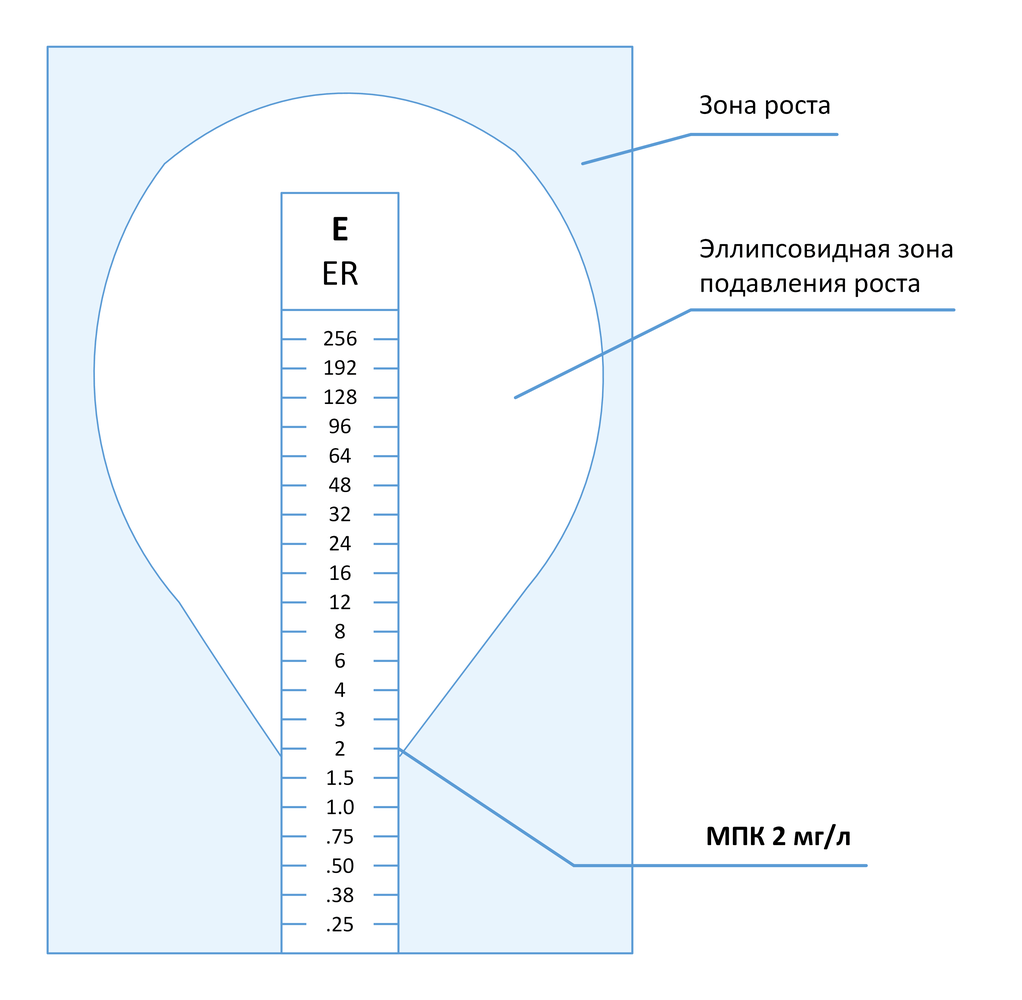
Метод градиентной диффузии представляет собой комбинацию методов последовательных разведений и диффузии антимикробных препаратов в агаре [37] . Коммерческие тесты, реализующие данный подход (Etest и M.T.S.), представляют собой тонкие полоски из инертного материала, на одну сторону которых нанесена шкала значений МПК и код препарата, а на другую – градиент концентраций препарата в сухом и стабилизированном виде. При наложении тест-полоски на поверхность агара, предварительно инокулированного тестируемой культурой микроорганизма, происходит высвобождение препарата и формирование стабильного и непрерывного градиента его концентраций в агаре. После инкубации вдоль тест-полоски формируется эллипсовидная зона подавления роста, в месте пересечения которой с нанесенной на полоску шкалой считывается значение МПК (в общем случае).
Преимущества:
- Высокая воспроизводимость результатов;
- Количественная оценка (определение МПК);
- Стандартизация;
- Гибкость;
- Возможность тестирования большинства клинически значимых видов бактерий;
- Широкий диапазон концентраций;
- Технологическая простота.
Ограничения:
- Высокая стоимость.
Качество коммерческих продуктов должно быть гарантировано производителем, а контроль качества результатов, получаемых при их использовании в лаборатории, является ответственностью пользователей.
3.5.1.3 Диско-диффузионный метод
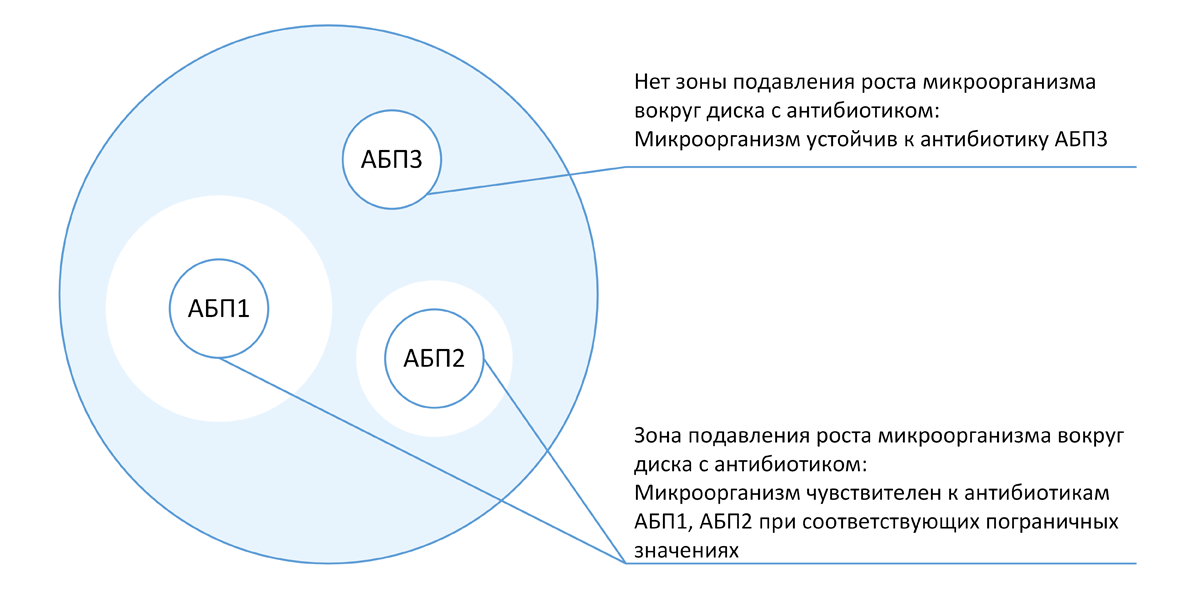
Диско-диффузионный метод (ДДМ) является одним из первых методов определения чувствительности к антибиотикам и до настоящего времени остается наиболее распространенным в практических бактериологических лабораториях. Метод может применяться для исследования большинства бактериальных возбудителей, в том числе и наиболее распространенных бактерий со сложными питательными потребностями, является универсальным для широкого круга антибиотиков, не требует использования специального оборудования и, при условии строгого соблюдения процедуры тестирования, а также использования качественных материалов (дисков и сред), обеспечивает получение достоверных результатов.
Преимущества:
- Высокая стандартизация (при соблюдении методики исследования);
- Высокая воспроизводимость;
- Гибкость (широкий спектр и различные комбинации антибиотиков, возможность выявления отдельных механизмов резистентности);
- Технологическая доступность;
- Относительно низкая стоимость;
- Возможность автоматизации этапа учета и интерпретации результатов.
Ограничения:
- Непрямой полуколичественный метод;
- Используется преимущественно для быстро растущих бактерий;
- Необходимость строгого контроля качества;
- Невозможность достоверного определения чувствительности к отдельным антибиотикам (например, полимиксинам, гликои липопептидам).
3.5.2 Интерпретация результатов определения чувствительности к антимикробным препаратам
Для обеспечения точности и сопоставимости результатов определения чувствительности к АМП необходимо использовать научно-обоснованные международные стандарты, которые содержат гармонизированные пограничные значения для интерпретации результатов.
В настоящее время в мире общепризнанными являются стандарты Института по клиническим и лабораторным стандартам США (CLSI) и Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST) [38] .
Основой рекомендаций по определению чувствительности в РФ с 2014 года является комплекс подходов к оценке чувствительности и интерпретации результатов, предлагаемый EUCAST.
Главная идея EUCAST заключается в разделении понятий микробиологической и клинической чувствительности/устойчивости микроорганизмов. Для каждого из понятий используются отдельные пограничные значения:
- для микробиологической чувствительности – эпидемиологические точки отсечения;
- для клинической чувствительности – клинические пограничные значения МПК и диаметров зон подавления роста.
Пограничные значения являются справочной информацией.
3.5.2.1 Эпидемиологические точки отсечения
С микробиологической точки зрения в пределах популяций отдельных видов бактерий EUCAST предлагает выделять следующие типы [39] :
- Дикий тип (wild type – WT), к которому относятся микроорганизмы, лишенные мутационных или других приобретенных механизмов устойчивости к конкретному антибиотику.
- Недикий тип (non-wild type – NWT), к которому относятся микроорганизмы, обладающие мутационными или другими приобретенными механизмами устойчивости к конкретному антибиотику.
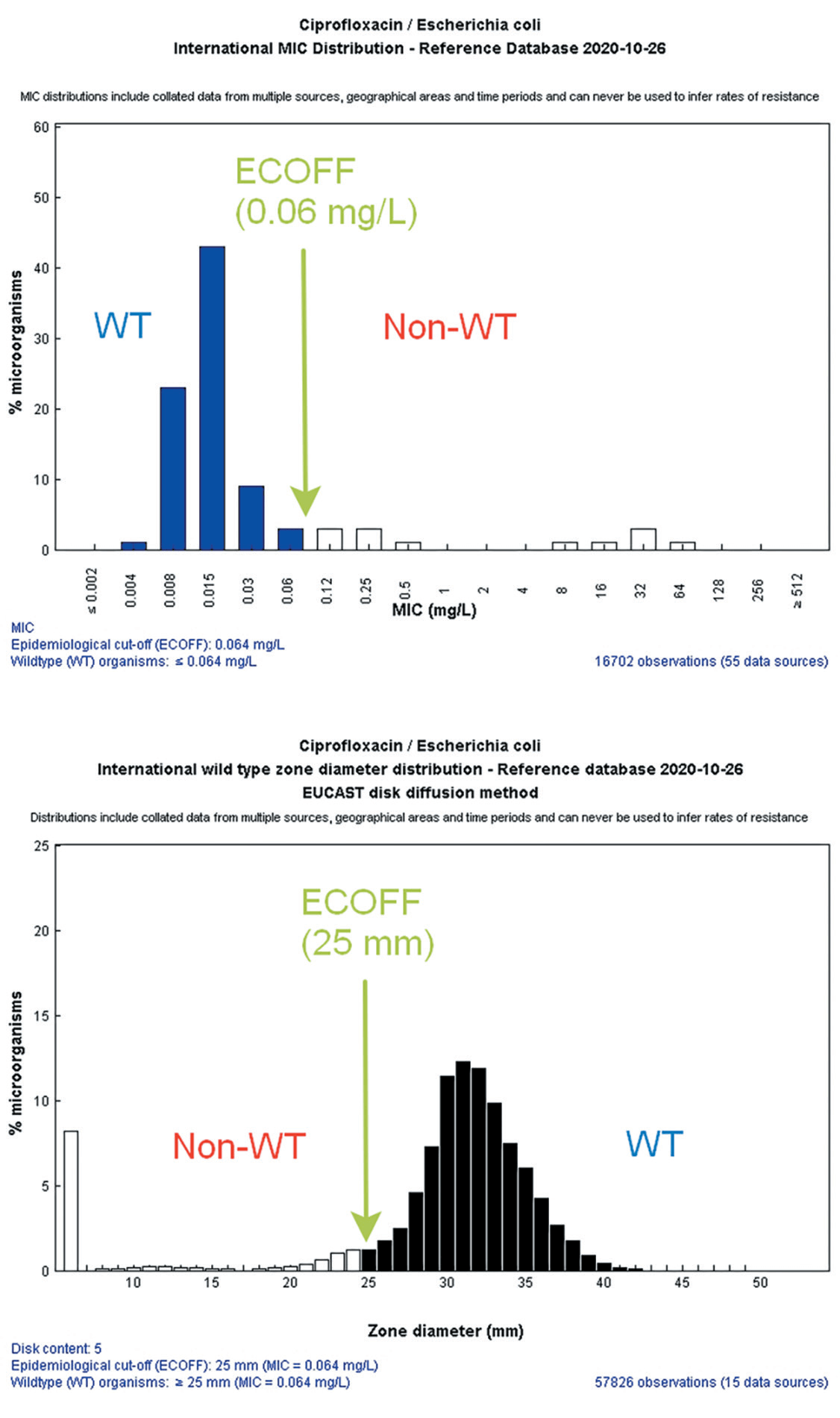
Принадлежность микроорганизма к одному из данных типов (дикий и недикий) оценивается на основании пороговых значений МПК антибиотиков, получивших название «эпидемиологические точки отсечения» (epidemiological cut-off values, ECOFF). ECOFF – это максимальное значение МПК (или наименьшее значение диаметра зоны подавления роста) конкретного АМП среди штаммов микроорганизмов в пределах одного вида, у которых отсутствует фенотипически выраженная устойчивость.
Значения ECOFF для конкретных комбинаций микроорганизм-антибиотик являются справочными и определяются статистическими методами на основании анализа характера распределения МПК антибиотика в отношении репрезентативной выборки изолятов соответствующего микроорганизма [40] . Эти значения являются постоянными видовыми признаками микроорганизмов и не зависят от изменяющихся обстоятельств. Гистограммы и таблицы распределения МПК (а также диаметров зон подавления роста, полученных с использованием ДДМ EUCAST) основных антибиотиков в отношении значительной части возбудителей инфекционных заболеваний человека доступны на веб-сайте EUCAST (http://mic.eucast.org). Значения ECOFF используются для дифференциации микроорганизмов, обладающих и не обладающих приобретенными механизмами резистентности, и могут отличаться от пограничных значений, используемых для определения клинических категорий чувствительности к антибиотику.
3.5.2.2 Клинические категории чувствительности
С практической точки зрения наиболее важной является классификация возбудителей инфекций по клиническим категориям чувствительности. Данные категории определяют вероятность достижения клинического эффекта при применении препарата. На протяжении ряда лет определения клинических категорий подвергались неоднократному пересмотру. С 2019 г. EUCAST использует следующие определения клинических категорий чувствительности [38] :
- Чувствительный при стандартном режиме дозирования (Ч) / Susceptible, standard dosing regimen (S). Микроорганизм оценивается как «Чувствительный при стандартном режиме дозирования» при высокой вероятности эффективности терапии при стандартном режиме дозирования.
- Чувствительный при увеличенной экспозиции антимикробного препарата (У) / Susceptible, Increased exposure (I). Микроорганизм оценивается как «Чувствительный при увеличенной экспозиции», при высокой вероятности эффективности терапии при увеличении экспозиции препарата путем коррекции режима дозирования или благодаря его концентрации в очаге инфекции [41] .
- Резистентный (Р) / Resistant (R). Микроорганизм оценивается как «Резистентный» при высокой вероятности терапевтической неудачи даже при увеличенной экспозиции препарата.
Для определения клинических категорий чувствительности устанавливаются клинические пограничные значения МПК и диаметров зон подавления роста. С целью определения пограничных значений проводятся исследования взаимосвязи между величиной МПК антибактериального препарата в отношении возбудителя, фармакокинетическими/фармакодинамическими характеристиками препарата и эффективностью лечения.
Клинические пограничные значения (МПК и ДДМ) могут пересматриваться при появлении новых данных о фармакокинетике и фармакодинамике антибиотиков и рекомендаций по режиму их применения. Ежегодно EUCAST публикует таблицы пограничных значений МПК и диаметров зон подавления роста для определения клинических категорий чувствительности бактерий к антимикробным препаратам (The European Committee in Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters), которые находятся в свободном доступе на сайте www.eucast.org.
Важно отметить что категория Чувствительный при увеличенной экспозиции антимикробного препарата (У) / Susceptible, Increased exposure (I) была введена EUCAST взамен ранее использованной Умеренно-резистентный / Intermediate. Одновременно с введением новых определений категорий чувствительности были соответствующим образом изменены пограничные значения (МПК и ДДМ) для некоторых антибиотиков. Поэтому новые определения категорий чувствительности могут использоваться только при условии соблюдения методологии исследования и оценки результатов в соответствии с новыми рекомендациями EUCAST (версии начиная с 2019 г.).
Новые определения предполагают, что для терапии могут быть использованы антибиотики, чувствительность к которым была оценена как Ч (S), так и У (I). Однако категория У (I) означает, что экспозиция препарата должна быть увеличена в соответствии с инструкцией по применению препарата. В большинстве случаев (за исключением инфекций мочевых путей) это требует увеличения дозы, уменьшения интервала дозирования или изменения пути введения, например с перорального на в/в или с короткой в/в инфузии на продленную инфузию.
Для препаратов, экспозиция которых не может быть значимо увеличена, категории У (I) не существует.
3.5.3 Выбор антимикробных препаратов для определения чувствительности
Создание единого перечня АМП для определения чувствительности во всех лабораториях является трудно выполнимой задачей.
Основными причинами этого являются:
- разнообразие имеющихся на рынке АМП;
- различия между лечебными учреждениями по контингенту пациентов;
- различная этиологическая структура инфекций в разных регионах и медицинских организациях;
- распространенность механизмов приобретенной резистентности.
В то же время решение задач эпидемиологического наблюдения за антибиотикорезистентностью требует использования унифицированной панели АМП, включающей все группы антимикробных препаратов.
Согласно современным представлениям, правильно подобранный набор антибиотиков для тестирования в совокупности с корректной идентификацией выделенного возбудителя позволяет с высокой долей вероятности предположить наличие механизмов резистентности у исследуемого изолята и предсказать его чувствительность/резистентность к другим, близким по структуре и/или механизму действия АМП. Эти принципы лежат в основе правил интерпретации результатов определения чувствительности бактерий к антибиотикам [42] .
3.5.3.1 Принципы выбора антибиотиков для определения чувствительности
1. Проводить идентификацию микроорганизма-возбудителя.
Без видовой идентификации бактерии нельзя точно проанализировать профиль резистентности в силу наличия природных и множественных приобретенных механизмов резистентности. Клиническое значение одного и того же механизма резистентности неодинаково у разных видов бактерий. Также и резистентность, обусловленная одной и той же детерминантой, фенотипически может легко выявляться у одних видов и с трудом – у других.
С другой стороны, информация о природной резистентности может быть исключительно важной для выяснения или подтверждения видовой идентификации. По этой причине, ряд антибиотиков, которые не используются для лечения инфекции, вызванной предполагаемым возбудителем, могут включаться в набор для определения чувствительности представителей некоторых определенных видов и родов.
2. Выбирать АМП, активные в отношении выделенного микроорганизма.
Определение чувствительности к антибиотикам, природно неактивным в отношении данного вида (группы) бактерий, не имеет терапевтического значения. Природная (врожденная) резистентность к АМП, в противовес приобретенной и/или мутационной резистентности, является свойством всех или почти всех изолятов бактериального вида. Примерами природной резистентности является резистентность представителей порядка Enterobacterales к гликопептидам и линезолиду, Proteus mirabilis – к нитрофурантоину и колистину, Serratia marcescens – к колистину, Stenotrophomonas maltophilia – к карбапенемам, грамположительных бактерий – к азтреонаму, энтерококков – к фузидиевой кислоте и т.д. Подробная информация о природной устойчивости доступна на сайте EUCAST в разделе «Expert rules and intrinsic resistance» (https://www.eucast.org/expert_rules_and_intrinsic_resistance).
3. Выбирать один антибиотик в качестве индикаторного.
Объединение антибиотиков в группы и классы основано, прежде всего, на их структурном сходстве и подобном механизме действия. Некоторые классы антибиотиков, такие как макролиды и линкозамиды, несмотря на различную химическую структуру, имеют одну и ту же мишень действия внутри бактериальной клетки и, таким образом, могут рассматриваться в свете интерпретации результатов определения чувствительности in vitro, как единая функциональная группа. Кроме того, в пределах некоторых групп АМП можно выделить подгруппы препаратов, в отношении которых бактерии проявляют полную перекрестную резистентность. Следовательно, результаты определения чувствительности могут и должны интерпретироваться для класса или группы антибиотиков, а не индивидуально для каждого препарата.
В этих случаях на практике достаточно оценивать чувствительность только к одному АМП данной группы. Такой препарат должен наилучшим образом выявлять механизм(ы), определяющий(ие) устойчивость возбудителя ко всем или большинству представителей этой группы, даже если он не применяется в терапевтических целях. Определение чувствительности in vitro к другим представителям данной группы не требуется, и более того, в отдельных случаях может привести к получению недостоверных результатов. Это объясняется плохой воспроизводимостью результатов при исследовании некоторых препаратов in vitro, и/или невозможностью провести надежную корреляцию между результатами определения чувствительности in vitro и клинической эффективностью.
Например, оксациллин и цефокситин, используются для выявления резистентности ко всем β-лактамам у стафилококков (MRSA), при этом для тестирования стафилококков in vitro не используется ни один другой β-лактамный антибиотик; оксациллин используется для скрининга резистентности к пенициллину у пневмококков; для скрининга наличия ESBL у энтеробактерий рекомендуется использовать как минимум два цефалоспорина.
Индикаторный препарат
представитель класса или группы антибиотиков, по результату определения чувствительности к которому можно с высокой степенью вероятности судить о чувствительности (резистентности) не только к данному препарату, но и к родственным антибиотикам.4. Учитывать дополнительную информацию.
При выборе АМП для тестирования необходимо учитывать информацию о типе инфекции (внебольничная или нозокомиальная), распространенности резистентных штаммов в стране, регионе и стационаре. Это позволит составить оптимальную панель АМП для определения чувствительности в каждом конкретном лечебном учреждении.
3.5.3.2 Перечень антибиотиков, рекомендованный для проведения эпидемиологического наблюдения за антибиотикорезистентностью приоритетных возбудителей
Предлагаемый перечень АМП может быть использован как при определении чувствительности с терапевтической целью, так и для проведения эпидемиологического наблюдения за АР. Данный перечень не является исчерпывающим. При появлении новых данных и новых АМП, а также в зависимости от локальных приоритетов, перечень может быть пересмотрен [43] .
Ниже указаны приоритетные для мониторинга АР препараты в зависимости от вида и/или группы микроорганизмов. В первом столбце («Определение чувствительности in vitro к препаратам») указаны приоритетные для мониторинга АР препараты, во втором столбце («Результат «Р» распространяется на препараты») указаны препараты/группы препаратов к которым с высокой степенью вероятности ожидается наличие резистентности (категория Р/R) при резистентности (категория Р/R) к препарату в первом столбце. Таким образом, используя для мониторинга АР указанные препараты из первого столбца можно прогнозировать (экстраполировать) наличие резистентности (категория Р/R) к другим препаратам. Если наименования препаратов в первом и втором столбце полностью совпадают, то наличие резистентности (категория Р/R) распространяется только на данный препарат (препараты из этого же класса следует оценивать отдельно). Следует отметить, что представленные таблицы составлены только для прогнозирования (экстраполяции) категории Р (R), экстраполяция категорий Ч (S) и УР (I) зависит от конкретных механизмов резистентности и их комбинаций, что требует отдельного рассмотрения каждого случая.
Enterobacterales
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Ампициллин или амоксициллин |
Аминопенициллины (ампициллин, амоксициллин), цефалоспорины I поколения
|
|
Амоксициллин/ клавулановая кислота |
Амоксициллин/клавулановая кислота, ампициллин/сульбактам
|
| Пиперациллин-тазобактам | Пиперациллин/тазобактам, амоксициллин/клавулановая кислота, ампициллин/сульбактам, цефоперазон-сульбактам |
| Цефотаксим или цефтриаксон |
Цефалоспорины III поколения (цефотаксим, цефтриаксон)
|
| Цефтазидим |
Цефтазидим
|
| Цефепим |
Цефепим
|
| Цефтазидим-авибактам |
Цефтазидим/авибактам
|
| Гентамицин или тобрамицин | Гентамицин, тобрамицин |
| Амикацин | Амикацин |
| Ципрофлоксацин или левофлоксацин |
Фторхинолоны (ципрофлоксацин, левофлоксацин, моксифлоксацин и др.)
|
| Пефлоксацин (ДДМ) скрининг |
Фторхинолоны (ципрофлоксацин, левофлоксацин, моксифлоксацин и др.)
|
| Имипенем | Имипенем |
| Меропенем |
Меропенем, дорипенем, эртапенем
|
| Эртапенем |
Эртапенем
|
| Колистин |
Полимиксины (колистин, полимиксин В)
|
| Фосфомицин |
Фосфомицин
|
| Нитрофурантоин |
Нитрофурантоин
|
P. aeruginosa
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Пиперациллин-тазобактам | Пиперациллин/тазобактам |
| Цефтазидим | Цефтазидим |
| Цефепим | Цефепим |
| Азтреонам | Азтреонам |
| Цефтолозан-тазобактам |
Цефтолозан/тазобактам
|
| Цефтазидим-авибактам |
Цефтазидим/авибактам
|
| Гентамицин или тобрамицин | Гентамицин, тобрамицин |
| Амикацин | Амикацин |
| Ципрофлоксацин или левофлоксацин | Фторхинолоны (ципрофлоксацин, левофлоксацин) |
| Имипенем | Имипенем |
| Меропенем | Меропенем, дорипенем |
| Колистин |
Полимиксины (колистин, полимиксин В)
|
Acinetobacter spp.
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Гентамицин или тобрамицин | Гентамицин, тобрамицин |
| Амикацин | Амикацин |
| Ципрофлоксацин или левофлоксацин | Фторхинолоны (ципрофлоксацин, левофлоксацин) |
| Имипенем | Имипенем |
| Меропенем | Меропенем |
| Колистин |
Полимиксины (колистин, полимиксин В)
|
|
Триметоприм/ сульфаметоксазол |
Триметоприм/сульфаметоксазол |
S. aureus
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
|
Цефокситин
(ДДМ) скрининг Оксациллин (МПК) скрининг |
Антистафилококковые бета-лактамы (оксациллин, амоксициллин/клавулановая кислота, ампициллин/сульбактам, цефазолин, цефуроксим, карбапенемы), кроме анти-MRSA цефемов (цефтаролин, цефтобипрол)
|
| Цефтаролин |
Цефтаролин
|
| Ципрофлоксацин или левофлоксацин или офлоксацин | Фторхинолоны (ципрофлоксацин, левофлоксацин, офлоксацин) |
| Норфлоксацин (ДДМ) скрининг | Скрининг резистентности к ципрофлоксацину, левофлоксацину, офлоксацину, моксифлоксацину |
| Ванкомицин |
Ванкомицин
|
| Линезолид | Линезолид |
| Рифампицин | Рифампицин |
| Эритромицин |
Макролиды (эритромицин, азитромицин, кларитромицин, рокситромицин и др.)
|
| Клиндамицин |
Клиндамицин, линкомицин, макролиды
|
| Гентамицин | Аминогликозиды |
S. pneumoniae
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
|
Оксациллин
(ДДМ) скрининг |
Первичный скрининг для выявления возможной резистентности к другим бета-лактамам (пенициллин, ампициллин, амоксициллина, амоксициллин/клавулановая кислота, ампициллин/сульбактам, пиперациллин, пиперациллин/тазобактам, цефотаксим, цефтриаксон, цефепим, цефтаролин, цефтобипрол, эртапенем, имипенем, меропенем) |
| Пенициллин (МПК) |
Пенициллин
|
| Цефотаксим или цефтриаксон |
Цефотаксим, цефтриаксон
|
| Цефтаролин |
Цефтаролин
|
| Эртапенем |
Эртапенем
|
| Эритромицин |
Макролиды (эритромицин, кларитромицин, азитромицин, рокситромицин и др.)
|
| Клиндамицин |
Клиндамицин, линкомицин, макролиды
|
| Левофлоксацин или моксифлоксацин | Левофлоксацин, моксифлоксацин |
| Норфлоксацин (ДДМ) скрининг | Скрининг резистентности к левофлоксацину, моксифлоксацину |
E. faecalis, E. faecium
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Ампициллин или амоксициллин | Аминопенициллины (ампициллин, амоксициллин) |
| Гентамицин (высокая концентрация) скрининг |
Гентамицин
|
| Ципрофлоксацин или левофлоксацин |
Ципрофлоксацин, левофлоксацин
|
| Норфлоксацин (ДДМ) скрининг |
Скрининг резистентности к ципрофлоксацину, левофлоксацину
|
| Ванкомицин | Ванкомицин |
| Линезолид | Линезолид |
3.5.3.3 Стратегия интерпретации результатов определения чувствительности
Основой стратегии интерпретации результатов определения чувствительности является составление профиля чувствительности исследуемого образца не только на основании результатов изучения отдельных антибиотиков, но и механизмов резистентности, лежащих в его основе.
Стратегия состоит из трех этапов:
- Характеристика фенотипа резистентности на основании анализа полученных результатов исследований выбранного набора антибиотиков;
- Предположение о наличии определенного механизма резистентности на основе фенотипа;
- Прогнозирование фенотипа резистентности к другим антибиотикам, исходя из предполагаемого механизма резистентности.
Оптимальное выявление и характеристика фенотипа резистентности предполагает изучение минимального количества антибиотиков, принадлежащих к одному и тому же классу, в случае различных механизмов резистентности (например, аминогликозидов) или репрезентативных представителей большой группы (β-лактамы).
Наиболее полное и систематизированное описание данной стратегии представлено в документе Европейского комитета по определению чувствительности (EUCAST), известном под названием «Экспертные правила определения чувствительности к антибиотикам EUCAST» [44] .
Изменено 15 января 2024