Это многостраничный вид для печати этого раздела. Нажмите здесь для печати.
3. Реализация системы мониторинга антибиотикорезистентности
- 3.1 Базовые понятия
- 3.2 Показания и особенности взятия биоматериала для микробиологического исследования
- 3.3 Оформление направления на микробиологическое исследование
- 3.4 Основные процедуры в микробиологической лаборатории
- 3.5 Методы определения чувствительности микроорганизмов к антимикробным препаратам и интерпретация результатов
- 3.6 Методы выявления механизмов резистентности, имеющих клиническое и эпидемиологическое значение
3.1 Базовые понятия
Микробная колонизация
это заселение участков кожи, слизистых оболочек и различных изделий медицинского назначения микроорганизмами, не сопровождающееся признаками и симптомами заболевания.Как правило, происходит колонизация тканей организма, которые находятся в контакте с внешней средой (слизистые оболочки мочеполового и пищеварительного тракта, дыхательных путей, кожа и конъюнктива). Микроорганизмы, колонизирующие эти области, имеют различные механизмы адгезии, способны преодолевать и выдерживать постоянное сопротивление защитных механизмов макроорганизма, таким образом, находясь с последним в состоянии динамического равновесия без причинения вреда в данный момент времени.
Инфекция
это инвазия и размножение чужеродных агентов в организме хозяина, приводящие к патологическому состоянию или заболеванию.В результате инфекции, т.е. проникновения чужеродного агента в организм хозяина, размножения в нем, высвобождения продуктов метаболизма (ферменты, эндо- и экзотоксины) нарушаются нормальные физиологические процессы, постоянство внутренней среды (гомеостаз) в организме хозяина. Это приводит к мобилизации неспецифических и специфических механизмов защиты, направленных на уменьшение или ликвидацию чужеродного агента с целью компенсации повреждения.
Почему для задач мониторинга АР важно различать колонизацию и инфекцию?
С точки зрения мониторинга АР принципиально важным является разделение всех выделенных от пациента микроорганизмов на:
- клинически значимые изоляты, т.е. изоляты являющиеся причиной инфекционного процесса конкретной локализации (например, S. pneumoniae при инфекциях нижних дыхательных путей, E. coli при глубоких инфекциях в области хирургического вмешательства);
- колонизирующие, т.е. микроорганизмы не являющиеся причиной инфекции конкретной локализации (например, зеленящие стрептококки в ротовой полости, S. epidermidis на поверхности кожи; E. coli на поверхности мочевого катетера при отсутствии симптомов инфекции мочевыводящих путей; микроорганизмы, выделенные из нестерильных локусов при исследовании на носительство). Следует отметить, что при наличии определенных условий (входные ворота инфекции, ослабленный иммунный статус и т.п.), колонизирующий изолят способен вызвать инфекционный процесс, т.е. стать клинически значимым.
Клинически значимые изоляты в действительности отражают этиологическую структуру с соответствующим профилем резистентности для конкретной нозологии (т.е. при уже совершившемся случае инфекции). В свою очередь, колонизирующие изоляты отражают состояние микробиоты (с характерным профилем резистентности) и представляют потенциальных возбудителей инфекций (однако сам случай инфекции отсутствует). Данная классификация является условной. С точки зрения оценки трендов АР и последующего составления локальных протоколов по антимикробной терапии наибольшую ценность представляют клинически значимые изоляты.
Следует обратить внимание, что для отдельных категорий пациентов (например, новорожденные дети, онкогематологические и иммунокомпрометированные пациенты) колонизирующие изоляты имеют особое значение, т.к. с большей вероятностью (в силу особенностей статуса макроорганизма) могут стать этиологическим агентом при наступлении случая инфекции.
С понятием «клинически значимые» изоляты неразрывно связано определение случая инфекции.
Что такое эпидемиологическое определение случая инфекции?
Эпидемиологическое определение случая инфекции
это набор стандартных критериев для выявления у пациента определенного заболевания, синдрома или другого состояния с целью эпидемиологического надзора.Использование согласованного стандартного определения случая инфекции гарантирует, что все случаи эквивалентны, независимо от времени и места их идентификации, что обеспечивает сопоставимость данных. Стандартные эпидемиологические определения случаев инфекции представлены в приложении 6.5.
Что такое нозокомиальные инфекции и в чем заключается важность определения случая нозокомиальной инфекции с точки зрения мониторинга АР?
Согласно формальному определению ВОЗ, нозокомиальная инфекция (НИ)
это любое клинически распознаваемое инфекционное заболевание, которое развивается у пациента не менее чем через 48 часов после госпитализации (и не находившееся в инкубационном периоде на момент госпитализации), в течение 3 дней после выписки или 30 дней после операции (до 1 года – при наличии имплантатов), а также любое инфекционное заболевание сотрудника стационара, развившееся вследствие его работы в данном учреждении, вне зависимости от времени появления симптомов.Наиболее распространенными являются следующие типы НИ: инфекции нижних дыхательных путей, инфекции мочевыводящих путей, инфекции в области хирургического вмешательства, инфекции кровотока.
С точки зрения мониторинга АР принципиально важным является разделение инфекций на два типа: нозокомиальные и внебольничные (т.е. не удовлетворяющие критериям нозокомиальных). Данное разделение необходимо, так как для внебольничных и нозокомиальных инфекций одних и тех же локализаций существуют значимые различия в этиологической структуре и профиле резистентности возбудителей. Поэтому при статистической обработке данных необходимо производить расчеты показателей (частоты встречаемости возбудителя, относительное количество резистентных изолятов и т.п.) отдельно для каждого типа инфекций (Рисунок 1).
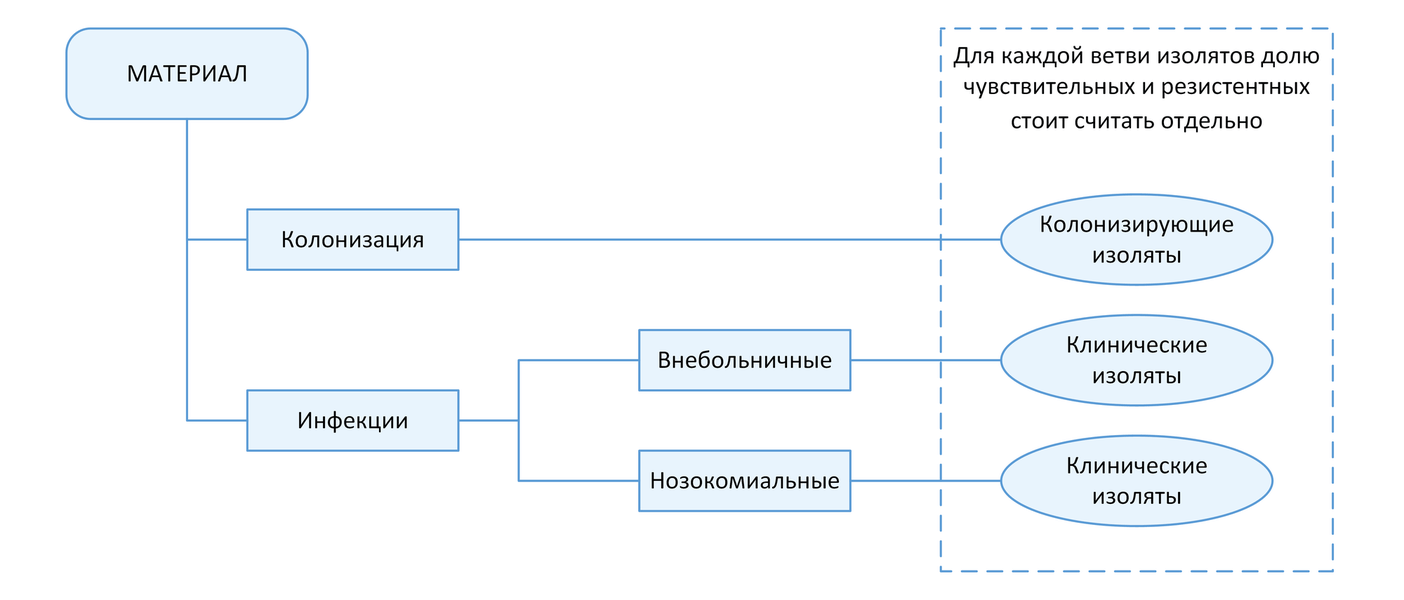
Какие микроорганизмы являются приоритетными для мониторинга АР?
Согласно рекомендациям ВОЗ (Cистема эпиднадзора за устойчивостью к противомикробным препаратам в Центральной Азии и Восточной Европе, 2019 г.) первоочередной интерес для мониторинга АР представляют девять видов (групп) микроорганизмов [27] :
- Escherichia coli (E. coli);
- Klebsiella pneumoniae (K. pneumoniae);
- Salmonella spp.;
- Pseudomonas aeruginosa (P. aeruginosa);
- Acinetobacter spp.;
- Staphylococcus aureus (S. aureus);
- Streptococcus pneumoniae (S. pneumoniae);
- Enterococcus faecalis (E. faecalis);
- Enterococcus faecium (E. faecium).
В качестве ориентира для формирования списка приоритетных для мониторинга АР возбудителей в РФ можно также использовать данные AMRmap (https://amrmap.ru система мониторинга АР национального уровня). Частота встречаемости различных возбудителей внебольничных и нозокомиальных инфекций в РФ (согласно данным AMRmap) представлена в таблице 3.1.1. Возбудители частота встречаемости которых не превышает 2% в таблицу не включены.
Таблица 3.1.1. Частота встречаемости различных видов микроорганизмов при внебольничных и нозокомиальных инфекция в РФ согласно данным AMRmap
| Вид | Абсолютная частота (N) | Относительная частота (%) |
|---|---|---|
| Нозокомиальные | ||
| Pseudomonas aeruginosa | 5049 | 19.31 |
| Klebsiella pneumoniae | 4975 | 19.02 |
| Acinetobacter baumannii | 3583 | 13.7 |
| Staphylococcus aureus | 3378 | 12.92 |
| Escherichia coli | 3187 | 12.19 |
| Enterococcus faecalis | 1005 | 3.84 |
| Enterobacter cloacae | 744 | 2.85 |
| Proteus mirabilis | 696 | 2.66 |
| Stenotrophomonas maltophilia | 616 | 2.36 |
| Enterococcus faecium | 603 | 2.31 |
| Serratia marcescens | 528 | 2.02 |
| Внебольничные | ||
| Escherichia coli | 3633 | 22.43 |
| Streptococcus pneumoniae | 2916 | 18.01 |
| Staphylococcus aureus | 2293 | 14.16 |
| Streptococcus pyogenes | 2262 | 13.97 |
| Haemophilus influenzae | 1105 | 6.82 |
| Klebsiella pneumoniae | 925 | 5.71 |
| Neisseria gonorrhoeae | 679 | 4.19 |
| Pseudomonas aeruginosa | 472 | 2.91 |
| Enterococcus faecalis | 335 | 2.07 |
Следует отметить, что при налаженном процессе локального мониторинга АР не представляет сложности расширить предложенный список микроорганизмов. Более того, включение всех выделяемых видов микроорганизмов в процесс мониторинга АР (учитывая тип инфекции и колонизацию) является предпочтительным, т.к. позволяет получить полное представление о локальной эпидемиологии АР.
Какое количество изолятов является репрезентативным для мониторинга АР?
В рамках мониторинга АР осуществляется расчет различных показателей, как правило выраженных в абсолютных и относительных частотах. Например, расчет и оценка доли (%) конкретного микроорганизма в этиологической структуре возбудителей инфекций или оценка доли резистентных изолятов. Ввиду различного объема выборки (количества изолятов) степень уверенности в достоверности полученных показателей может быть различной. Для объективной оценки степени уверенности (доверия) в полученных данных существует специальный показатель – доверительный интервал (ДИ). Наиболее часто используемым ДИ в биомедицинских исследованиях является 95%-ый ДИ [28] . Он представлен в виде интервальных значений, например, 50% резистентных изолятов (95%-ый ДИ: 30–70%). Доверительный интервал (95%-ый ДИ), означает, что при повторном проведении 100 исследований с таким же дизайном истинное значение оцениваемого показателя (в данном примере доли резистентных изолятов) в 95 исследованиях из 100 будет находиться в пределах указанной ширины интервала (в данном примере ширина – от 30 до 70%). Таким образом, в указанном примере несмотря на оценку доли резистентных изолятов в 50%, истинная доля может находиться в пределах 30–70%.
ДИ напрямую связан с объемом выборки (количеством изолятов): чем больше объем выборки (количество изолятов), тем меньше ширина ДИ (т.е. большая точность оценки), и наоборот. ДИ рассчитывается с помощью специальных формул. Однако для приблизительной оценки необходимого объема выборки (точности оценки) можно ориентрироваться на значения, представленные в таблице 3.1.2.
Таблица 3.1.2. Ширина 95%-ого ДИ в зависимости от объема выборки
| Объем выборки (количество изолятов) | Ширина 95%-ого ДИ (в %) |
|---|---|
| 20 | ± 20,07 |
| 40 | ± 14,08 |
| 80 | ± 10,70 |
| 100 | ± 6,86 |
| 200 | ± 4,88 |
| 300 | ± 3,99 |
| 500 | ± 3,09 |
Исходя из таблицы 3.1.2., при выборке в 20 изолятов истинное значение доли резистентных изолятов будет находиться в пределах ± 20,07%. Например, если 10 из 20 (т.е. 50%) протестированных изолятов резистентны к конкретному антимикробному препарату, то истинное значение доли резистентных изолятов будет находиться в пределах 50 ± 20,07%. Такой же принцип действителен при оценке этиологической структуры. Например, при инфекциях конкретной локализации идентифицировано 80 изолятов из них 40 изолятов (50%) составляет Klebsiella pneumoniae, используя таблицу 3.1.2. можно приблизительно оценить истинное значение доли Klebsiella pneumoniae в общей структуре (50 ± 10,70%).
Следует отметить, что наряду с использованием ширины 95%-ого ДИ для вероятностной оценки точности и необходимого количества изолятов, с целью формирования репрезентативной выборки необходимо также учитывать «смещающие» факторы (например, включение в исследование только изолятов резистентных к конкретному АМП или включение дублей и повторных изолятов, см. раздел 4.3.).
3.2 Показания и особенности взятия биоматериала для микробиологического исследования
Показания для проведения МИ могут быть условно разделены на клинические и эпидемиологические.
Клинические:
- подтверждение диагноза или установление этиологии инфекционного процесса;
- обоснование выбора или смены АБТ;
- оценка эффективности АБТ.
Эпидемиологические:
- определение условно-патогенных возбудителей в воздухе, на объектах окружающей среды в стационаре;
- определение широты распространения, уровня и массивности носительства медперсоналом и пациентами возбудителей инфекций.
При определении показаний и подготовке пациента для МИ необходимо учитывать соответствие назначения клиническим рекомендациям и стандартам оказания медицинской помощи для соответствующей патологии.
Общие правила взятия и транспортировки клинического материала
Определение правил взятия и транспортировки клинического материала для МИ и разработка программ обучения медицинского персонала, участвующего в данном этапе диагностики, является обязанностью лаборатории.
Перед взятием образца, особенно при применении инвазивных методов, необходимо оценить соотношение риска и пользы для пациента, а также значимость данного вида клинического материала для целей объективизации клинического диагноза и оценки проводимых или планируемых лечебных мероприятий. Неадекватные и/или неправильно собранные образцы для исследования не обеспечивают получение полезной клинической информации и могут ввести в заблуждение.
Все медицинские работники, выполняющие взятие материала, должны проходить обучение (инструктаж) по правилам взятия и транспортировки материала для МИ. Периодичность инструктажа устанавливается внутренними правилами медицинской организации.
В случае самостоятельного сбора клинического материала (моча, мокрота) пациент должен получить четкие пошаговые инструкции (устные и/или письменные).
Взятие материала для исследования должно проводиться предпочтительно в острой фазе заболевания, до начала АБТ или непосредственно перед введением (приемом) очередной дозы антибиотика.
Внимание!
Необходимость взятия материала для микробиологического исследования не должна быть причиной отложенного начала антибактериальной терапии.При взятии материала необходимо руководствоваться следующими принципами:
- соблюдать технику асептики и антисептики для предотвращения инфицирования пациента в процессе выполнения инвазивных манипуляций;
- проводить взятие клинического материала непосредственно из очага инфекции;
- собирать клинический материал в количестве (вес, объем) достаточном для проведения исследования;
- обеспечить минимально возможную контаминацию материала нормальной микробиотой; (присутствие в заключении информации о представителях нормальной микробиоты может привести к ошибочной интерпретации результатов исследования материала нестерильных локусов организма, например, при исследовании мокроты, мазков из ротои носоглотки, гениталий и др.);
- использовать специализированные стерильные одноразовые контейнеры, предназначенные для сбора и транспортировки биологического материала, или транспортные системы, содержащие или не содержащие транспортную среду для сохранения жизнеспособности и количественного состава микроорганизмов, с плотно закрывающимися крышками.
Выбор контейнера для сбора клинического материала определяется типом пробы и целью МИ.
Некоторые образцы требуют специальной транспортной среды для сохранения микроорганизмов (например, исследования при подозрении на анаэробную инфекцию).
Образцы материала для МИ следует доставить в лабораторию в максимально короткие сроки (для большинства образцов не позднее 1,5–2 ч после их получения), за исключением случаев использования специальных изделий, допускающих отсроченную доставку материала в лабораторию.
Это обеспечивает:
- сохранение жизнеспособности возбудителей и возможности выделения микроорганизмов, требующих особых условий культивирования;
- предотвращение избыточного роста быстрорастущих микроорганизмов;
- поддержание соотношения исходных концентраций микроорганизмов в образце.
Основными требованиями к транспортировке клинического материала в микробиологическую лабораторию являются:
- наличие четкой маркировки образца для безошибочной идентификации;
- наличие заполненного бланка направления, содержащего необходимую клинико-демографическую и эпидемиологическую информацию;
- предотвращение контакта направления на исследование (и других сопроводительных материалов) с клиническим материалом (например, упаковка документов в отдельный пластиковый пакет);
- соблюдение дополнительных правил, предъявляемых к транспортировке отдельных видов клинического материала для МИ.
При невозможности немедленной доставки в лабораторию образцы хранят при температуре 2–8 °С за исключением следующих случаев:
- использование специальных транспортных систем, содержащих транспортную среду;
- подозрение на наличие температурозависимых микроорганизмов (Neisseria spp.) – временное хранение и доставка образцов осуществляется при температуре 18–20 °С.
Требования к взятию, хранению и транспортировке материала в микробиологическую лабораторию доступны в действующих на данный момент национальном стандарте и методических указаниях:
- ГОСТ Р 53079.4-2008. Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа [29] .
- МУ 4.2.2039-05. Техника сбора и транспортирования биоматериалов в микробиологические лаборатории [30] .
Указанные нормативные документы введены в действие более 10 лет назад и носят общий характер, в связи с чем целесообразна разработка соответствующих локальных стандартных операционных процедур, учитывающих профиль выполняемых исследований. При этом полезно ориентироваться на рекомендации, отражающие современное состояние лабораторных технологий, например, для посева крови [31] .
При возникновении вопросов необходимо проконсультироваться со специалистами лаборатории.
3.3 Оформление направления на микробиологическое исследование
Клинические и демографические данные являются необходимыми для оптимизации процедуры исследования в лаборатории (выбор питательных сред для первичного посева и условий инкубации и др.), определения клинической значимости выделенных микроорганизмов и правильной интерпретации результатов исследования в целом. Сопроводительная информация, содержащаяся в направлении (вместе с полученными результатами идентификации и определения чувствительности выделенных возбудителей) будет являться частью массива данных для анализа в процессе мониторинга АР. Поэтому отдельное внимание должно быть уделено модификации или разработке бланка направления на МИ.
Образцы клинического материала должны отправляться в лабораторию в сопровождении бланка направления, включающего следующую информацию:
- фамилия, имя, отчество обследуемого;
- дата рождения;
- лечебное учреждение;
- отделение: наименование и профиль (например, хирургический, терапевтический);
- номер истории болезни или амбулаторной карты;
- диагноз и локализацию инфекционного процесса, явившегося поводом к МИ;
- тип инфекции в зависимости от времени возникновения (внебольничная или нозокомиальная);
- вид биологического материала;
- задачи исследования при необходимости (например, исследование мазка из ротоглотки с целью выявления Corynebacterium diphtheriae);
- дата и время взятия материала;
- получаемые антимикробные препараты;
- при направлении аутопсийного материала – отделение, в котором умер пациент, дату и время смерти, дату и время вскрытия;
- дополнительные клинические данные при необходимости (факторы риска развития инфекции и/или наличия резистентных возбудителей);
- фамилию, имя, отчество и контактный телефон врача, назначившего исследование.
Пример бланка направления на МИ представлен в приложении 6.1. Шаблон направления на микробиологическое исследование.
3.4 Основные процедуры в микробиологической лаборатории
В рамках микробиологического исследования проводят следующие процедуры:
1. Прием и оценка качества и репрезентативности биоматериала для микробиологического исследования в лаборатории.
При поступлении образцов биоматериала в лабораторию необходимо:
- Оценить полноту заполнения направления (сопроводительной информации) для МИ.
- Оценить качество образца (маркировка, целостность контейнера, соблюдение условий взятия и транспортировки (надлежащий контейнер/транспортная среда, сроки доставки и т.д.).
- Оценить соответствие вида клинического материала предполагаемой инфекционной патологии: локализация и возможность выделения вероятных возбудителей.
Внимание!
При выявлении несоответствий необходимо провести бракераж образцов, регистрацию выявленных несоответствий, а также информировать лечащего врача (или другое лицо, ответственное за взятие материла) и обсудить возможные дальнейшие действия. Основные процедуры описаны в ГОСТ ИСО 15189 «Лаборатории медицинские. Частные требования к качеству и компетентности».2. Посев на искусственные питательные среды, выделение чистой культуры и идентификация возбудителя
Питательные среды для первичного посева клинического материала и условия инкубации должны обеспечивать возможность выделения максимально широкого круга потенциальных возбудителей.
Выбор сред и условий инкубации определяется видом клинического материала, диагнозом инфекционной патологии и предполагаемыми возбудителями, задачами МИ, а также наличием дополнительных факторов риска присутствия нетипичных и/или резистентных возбудителей, и проводится в соответствии со стандартными процедурами лаборатории.
Внимание!
Выделение возбудителя в чистой культуре необходимо для выполнения фенотипического определения чувствительности к АМП и является обязательным условием осуществления мониторинга АР.3. Оценка клинического значения выделенных микроорганизмов
Проводится на основании результатов МИ с учетом клинико-демографических, эпидемиологических данных:
- видов выделенных микроорганизмов, их количественного соотношения при наличии ассоциаций;
- количества выделенных видов микроорганизмов;
- соответствие видов выделенных микроорганизмов локализации инфекции;
- соответствие видов выделенных микроорганизмов и результатов микроскопического исследования (обязательно: при исследовании крови, материала нижних дыхательных путей; рекомендуется при исследовании других видов материала по возможности);
- факторов риска развития инфекции и/или наличия резистентных возбудителей.
4. Определение чувствительности к антибиотикам и выявление механизмов резистентности клинически значимых возбудителей
Для мониторинга АР необходимо использовать результаты определения чувствительности возбудителей, выделенных в чистой культуре. Данные, полученные с помощью прямого определения чувствительности возбудителей в гемокультуре, не рекомендуется включать в мониторинг АР.
Молекулярно-генетические методы идентификации и выявления детерминант устойчивости возбудителей к АМП могут быть использованы как напрямую в клиническом материале, так и в выделенной чистой культуре возбудителя. Результаты выявления механизмов устойчивости к АМП молекулярно-генетическими методами также могут учитываться в процессе мониторинга, но они не заменяют в полном объеме и не исключают необходимости выполнения стандартных фенотипических методов определения чувствительности к АМП.
5. Формирование ответа (отчета) о результатах микробиологического исследования
В отчет о результатах индивидуального МИ следует включать информацию:
- результат микроскопического исследования (если проводилось);
- вид и количество (при количественном или полуколичественном исследовании) выделенных возбудителей, имеющих клиническое значение;
- результаты определения чувствительности к антибиотикам возбудителей, имеющих клиническое значение:
- клиническая категория чувствительности (Ч/S, У/I, Р/R, если установлены);
- значение МПК, мг/л (если определено);
- сравнение значения МПК с эпидемиологическими точками отсечения (где применимо при отсутствии клинических категорий чувствительности, см. раздел 3.5.);
- результаты выявления механизмов резистентности;
- дополнительные комментарии при необходимости.
Внимание!
Значение диаметров зон подавления роста, мм, не рекомендуется включать в отчет о результатах микробиологического исследования для лечащего врача. Но, как значения МПК, так и значения диаметров зон подавления роста, необходимо регистрировать в первичной документации лаборатории (протоколах исследования) на бумажных и/или электронных носителях.6. Организация, хранение данных
В рамках лаборатории могут использованы различные варианты работы с данными. Подробная информация представлена в разделе 4.1. Сценарии потоков данных.
3.5 Методы определения чувствительности микроорганизмов к антимикробным препаратам и интерпретация результатов
Основной целью оценки чувствительности микроорганизмов к антибиотикам является прогнозирование их эффективности при лечении инфекций у конкретных пациентов. Определение чувствительности также проводят с целью эпидемиологического наблюдения за распространением резистентности среди микроорганизмов и в процессе изучения новых препаратов.
Использование унифицированных методов определения чувствительности и подходов к интерпретации результатов является необходимым условием не только для правильного выбора АМТ у конкретного пациента, но и для формирования эффективной системы эпидемиологического наблюдения за антибиотикорезистентностью.
3.5.1 Методы определения чувствительности к антимикробным препаратам
Основным параметром, характеризующим взаимоотношения между микроорганизмом и антибиотиком, является величина минимальной подавляющей концентрации (МПК) препарата. МПК – это минимальная концентрация антибиотика, подавляющая видимый рост микроорганизма при его культивировании in vitro в стандартных условиях [32] . Относительно значений МПК, установленных референтным методом микроразведений, «калибруются» как наиболее распространенный в рутинной практике диско-диффузионный метод (ДДМ), так и различные коммерческие методы определения чувствительности [33] .
Результаты оценки чувствительности бактерий, полученные с помощью референтного метода, используют для обоснования микробиологических и клинических критериев оценки чувствительности [34] .
3.5.1.1 Метод последовательных разведений

Основным методом определения МПК является метод последовательных разведений. Для определения МПК заданные концентрации антибиотика (чаще всего с 2-кратным шагом) вносят в питательную среду, которую затем засевают культурой исследуемого микроорганизма и после инкубации оценивают наличие или отсутствие видимого роста в присутствии различных концентраций антибиотика. Известны два основных варианта постановки метода последовательных разведений: в агаре и в бульоне. Метод разведений в агаре в настоящее время используется в основном для определения чувствительности к отдельным антибиотикам, в частности, к фосфомицину. Метод последовательных разведений в бульоне, в свою очередь, может выполняться в макрои микро-варианте (в объеме ≤ 0,2 мл).
Метод последовательных микроразведений в бульоне является референтным методом определения МПК и регламентируется международным стандартом ISO 20776-1:2019 («Clinical laboratory testing and in vitro diagnostic test systems – Susceptibility testing of infectious agents and evaluation of performance of antimicrobial susceptibility test devices – Part 1: Reference method for testing the in vitro activity of antimicrobial agents against rapidly growing aerobic bacteria involved in infectious diseases») [35] . В Российской Федерации Приказом Федерального агентства по техническому регулированию и метрологии Российской Федерации от 23 ноября 2010 г. № 499-ст [36] утвержден и введен в действие Национальный Стандарт ГОСТ Р ИСО 20776-1-2010, идентичный международному стандарту ISO 20776-1 (в редакции 2006 г.).
Преимущества:
- Количественный (МПК – прямая количественная характеристика in vitro активности АМП);
- Стандартизированный;
- Гибкий (набор антибиотиков, широкий диапазон концентраций);
- Высокая воспроизводимость результатов;
- Возможность исследования чувствительности у большинства клинически значимых бактерий.
Ограничения:
- Трудоемкость;
- Высокие требования к квалификации и опыту персонала;
- Высокая стоимость (субстанции антибиотиков).
В настоящее время для практических лабораторий доступен целый ряд суррогатных методов определения МПК с использованием коммерческих расходных материалов, например: коммерческие варианты метода микроразведений в бульоне (автоматизированные и без автоматизации).
Преимущества:
- Меньше требований к контролю качества определения чувствительности в лаборатории (но не исключает его полностью!) при соблюдении условий транспортировки и хранения;
- При наличии программного обеспечения – автоматизированный учет результатов;
- Снижение трудозатрат;
- Не требуют высокой квалификации персонала.
Ограничения:
- Невозможность определения чувствительности всех клинически значимых видов бактерий;
- Фиксированный набор и ограниченный диапазон разведений антибиотиков;
- Относительно высокая стоимость.
3.5.1.2 Метод градиентной диффузии
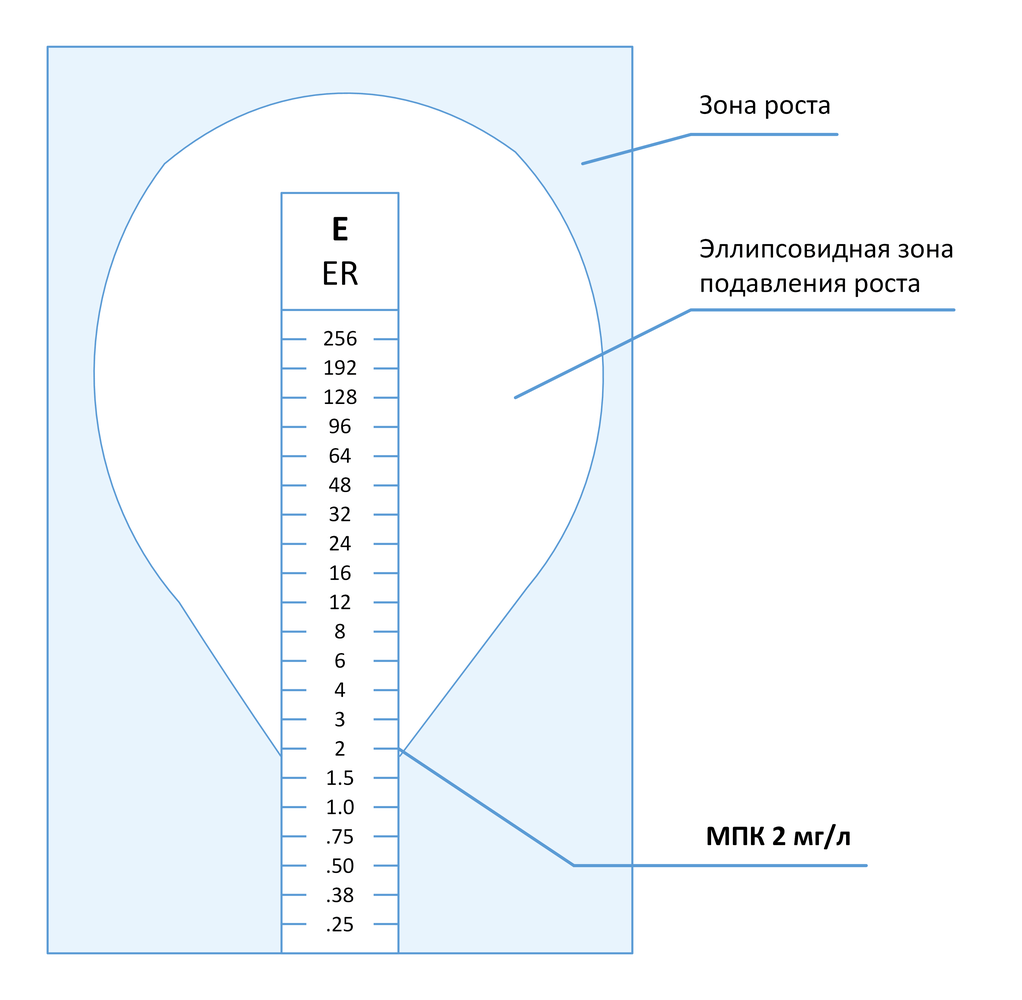
Метод градиентной диффузии представляет собой комбинацию методов последовательных разведений и диффузии антимикробных препаратов в агаре [37] . Коммерческие тесты, реализующие данный подход (Etest и M.T.S.), представляют собой тонкие полоски из инертного материала, на одну сторону которых нанесена шкала значений МПК и код препарата, а на другую – градиент концентраций препарата в сухом и стабилизированном виде. При наложении тест-полоски на поверхность агара, предварительно инокулированного тестируемой культурой микроорганизма, происходит высвобождение препарата и формирование стабильного и непрерывного градиента его концентраций в агаре. После инкубации вдоль тест-полоски формируется эллипсовидная зона подавления роста, в месте пересечения которой с нанесенной на полоску шкалой считывается значение МПК (в общем случае).
Преимущества:
- Высокая воспроизводимость результатов;
- Количественная оценка (определение МПК);
- Стандартизация;
- Гибкость;
- Возможность тестирования большинства клинически значимых видов бактерий;
- Широкий диапазон концентраций;
- Технологическая простота.
Ограничения:
- Высокая стоимость.
Качество коммерческих продуктов должно быть гарантировано производителем, а контроль качества результатов, получаемых при их использовании в лаборатории, является ответственностью пользователей.
3.5.1.3 Диско-диффузионный метод
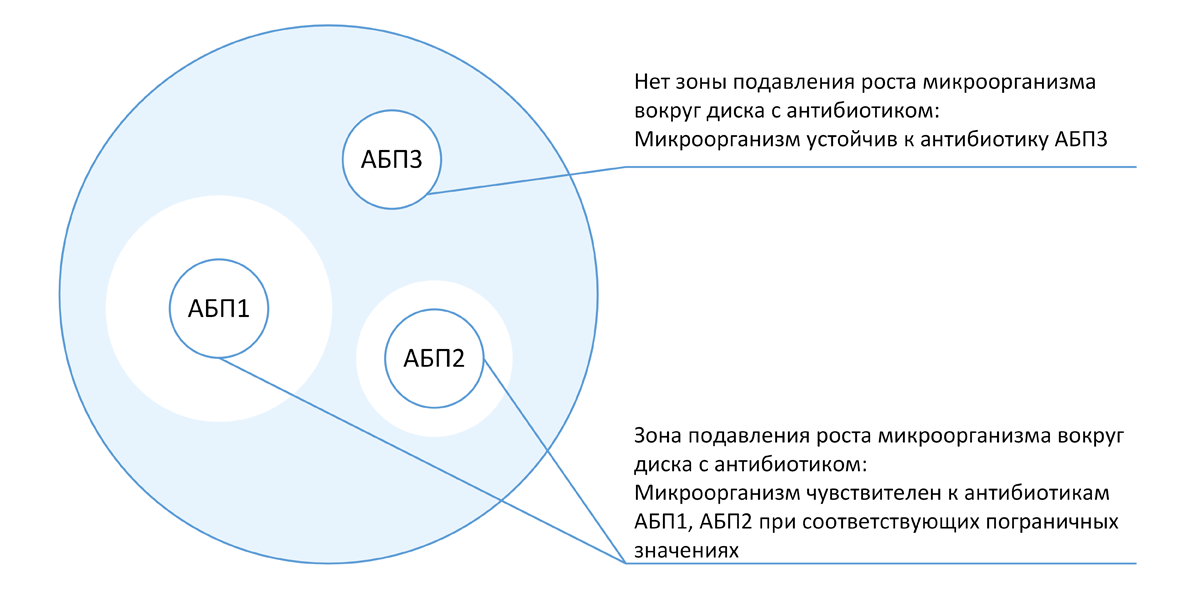
Диско-диффузионный метод (ДДМ) является одним из первых методов определения чувствительности к антибиотикам и до настоящего времени остается наиболее распространенным в практических бактериологических лабораториях. Метод может применяться для исследования большинства бактериальных возбудителей, в том числе и наиболее распространенных бактерий со сложными питательными потребностями, является универсальным для широкого круга антибиотиков, не требует использования специального оборудования и, при условии строгого соблюдения процедуры тестирования, а также использования качественных материалов (дисков и сред), обеспечивает получение достоверных результатов.
Преимущества:
- Высокая стандартизация (при соблюдении методики исследования);
- Высокая воспроизводимость;
- Гибкость (широкий спектр и различные комбинации антибиотиков, возможность выявления отдельных механизмов резистентности);
- Технологическая доступность;
- Относительно низкая стоимость;
- Возможность автоматизации этапа учета и интерпретации результатов.
Ограничения:
- Непрямой полуколичественный метод;
- Используется преимущественно для быстро растущих бактерий;
- Необходимость строгого контроля качества;
- Невозможность достоверного определения чувствительности к отдельным антибиотикам (например, полимиксинам, гликои липопептидам).
3.5.2 Интерпретация результатов определения чувствительности к антимикробным препаратам
Для обеспечения точности и сопоставимости результатов определения чувствительности к АМП необходимо использовать научно-обоснованные международные стандарты, которые содержат гармонизированные пограничные значения для интерпретации результатов.
В настоящее время в мире общепризнанными являются стандарты Института по клиническим и лабораторным стандартам США (CLSI) и Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST) [38] .
Основой рекомендаций по определению чувствительности в РФ с 2014 года является комплекс подходов к оценке чувствительности и интерпретации результатов, предлагаемый EUCAST.
Главная идея EUCAST заключается в разделении понятий микробиологической и клинической чувствительности/устойчивости микроорганизмов. Для каждого из понятий используются отдельные пограничные значения:
- для микробиологической чувствительности – эпидемиологические точки отсечения;
- для клинической чувствительности – клинические пограничные значения МПК и диаметров зон подавления роста.
Пограничные значения являются справочной информацией.
3.5.2.1 Эпидемиологические точки отсечения
С микробиологической точки зрения в пределах популяций отдельных видов бактерий EUCAST предлагает выделять следующие типы [39] :
- Дикий тип (wild type – WT), к которому относятся микроорганизмы, лишенные мутационных или других приобретенных механизмов устойчивости к конкретному антибиотику.
- Недикий тип (non-wild type – NWT), к которому относятся микроорганизмы, обладающие мутационными или другими приобретенными механизмами устойчивости к конкретному антибиотику.
Принадлежность микроорганизма к одному из данных типов (дикий и недикий) оценивается на основании пороговых значений МПК антибиотиков, получивших название «эпидемиологические точки отсечения» (epidemiological cut-off values, ECOFF). ECOFF – это максимальное значение МПК (или наименьшее значение диаметра зоны подавления роста) конкретного АМП среди штаммов микроорганизмов в пределах одного вида, у которых отсутствует фенотипически выраженная устойчивость.
Значения ECOFF для конкретных комбинаций микроорганизм-антибиотик являются справочными и определяются статистическими методами на основании анализа характера распределения МПК антибиотика в отношении репрезентативной выборки изолятов соответствующего микроорганизма [40] . Эти значения являются постоянными видовыми признаками микроорганизмов и не зависят от изменяющихся обстоятельств. Гистограммы и таблицы распределения МПК (а также диаметров зон подавления роста, полученных с использованием ДДМ EUCAST) основных антибиотиков в отношении значительной части возбудителей инфекционных заболеваний человека доступны на веб-сайте EUCAST (http://mic.eucast.org). Значения ECOFF используются для дифференциации микроорганизмов, обладающих и не обладающих приобретенными механизмами резистентности, и могут отличаться от пограничных значений, используемых для определения клинических категорий чувствительности к антибиотику.
3.5.2.2 Клинические категории чувствительности
С практической точки зрения наиболее важной является классификация возбудителей инфекций по клиническим категориям чувствительности. Данные категории определяют вероятность достижения клинического эффекта при применении препарата. На протяжении ряда лет определения клинических категорий подвергались неоднократному пересмотру. С 2019 г. EUCAST использует следующие определения клинических категорий чувствительности [38] :
- Чувствительный при стандартном режиме дозирования (Ч) / Susceptible, standard dosing regimen (S). Микроорганизм оценивается как «Чувствительный при стандартном режиме дозирования» при высокой вероятности эффективности терапии при стандартном режиме дозирования.
- Чувствительный при увеличенной экспозиции антимикробного препарата (У) / Susceptible, Increased exposure (I). Микроорганизм оценивается как «Чувствительный при увеличенной экспозиции», при высокой вероятности эффективности терапии при увеличении экспозиции препарата путем коррекции режима дозирования или благодаря его концентрации в очаге инфекции [41] .
- Резистентный (Р) / Resistant (R). Микроорганизм оценивается как «Резистентный» при высокой вероятности терапевтической неудачи даже при увеличенной экспозиции препарата.
Для определения клинических категорий чувствительности устанавливаются клинические пограничные значения МПК и диаметров зон подавления роста. С целью определения пограничных значений проводятся исследования взаимосвязи между величиной МПК антибактериального препарата в отношении возбудителя, фармакокинетическими/фармакодинамическими характеристиками препарата и эффективностью лечения.
Клинические пограничные значения (МПК и ДДМ) могут пересматриваться при появлении новых данных о фармакокинетике и фармакодинамике антибиотиков и рекомендаций по режиму их применения. Ежегодно EUCAST публикует таблицы пограничных значений МПК и диаметров зон подавления роста для определения клинических категорий чувствительности бактерий к антимикробным препаратам (The European Committee in Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters), которые находятся в свободном доступе на сайте www.eucast.org.
Важно отметить что категория Чувствительный при увеличенной экспозиции антимикробного препарата (У) / Susceptible, Increased exposure (I) была введена EUCAST взамен ранее использованной Умеренно-резистентный / Intermediate. Одновременно с введением новых определений категорий чувствительности были соответствующим образом изменены пограничные значения (МПК и ДДМ) для некоторых антибиотиков. Поэтому новые определения категорий чувствительности могут использоваться только при условии соблюдения методологии исследования и оценки результатов в соответствии с новыми рекомендациями EUCAST (версии начиная с 2019 г.).
Новые определения предполагают, что для терапии могут быть использованы антибиотики, чувствительность к которым была оценена как Ч (S), так и У (I). Однако категория У (I) означает, что экспозиция препарата должна быть увеличена в соответствии с инструкцией по применению препарата. В большинстве случаев (за исключением инфекций мочевых путей) это требует увеличения дозы, уменьшения интервала дозирования или изменения пути введения, например с перорального на в/в или с короткой в/в инфузии на продленную инфузию.
Для препаратов, экспозиция которых не может быть значимо увеличена, категории У (I) не существует.
3.5.3 Выбор антимикробных препаратов для определения чувствительности
Создание единого перечня АМП для определения чувствительности во всех лабораториях является трудно выполнимой задачей.
Основными причинами этого являются:
- разнообразие имеющихся на рынке АМП;
- различия между лечебными учреждениями по контингенту пациентов;
- различная этиологическая структура инфекций в разных регионах и медицинских организациях;
- распространенность механизмов приобретенной резистентности.
В то же время решение задач эпидемиологического наблюдения за антибиотикорезистентностью требует использования унифицированной панели АМП, включающей все группы антимикробных препаратов.
Согласно современным представлениям, правильно подобранный набор антибиотиков для тестирования в совокупности с корректной идентификацией выделенного возбудителя позволяет с высокой долей вероятности предположить наличие механизмов резистентности у исследуемого изолята и предсказать его чувствительность/резистентность к другим, близким по структуре и/или механизму действия АМП. Эти принципы лежат в основе правил интерпретации результатов определения чувствительности бактерий к антибиотикам [42] .
3.5.3.1 Принципы выбора антибиотиков для определения чувствительности
1. Проводить идентификацию микроорганизма-возбудителя.
Без видовой идентификации бактерии нельзя точно проанализировать профиль резистентности в силу наличия природных и множественных приобретенных механизмов резистентности. Клиническое значение одного и того же механизма резистентности неодинаково у разных видов бактерий. Также и резистентность, обусловленная одной и той же детерминантой, фенотипически может легко выявляться у одних видов и с трудом – у других.
С другой стороны, информация о природной резистентности может быть исключительно важной для выяснения или подтверждения видовой идентификации. По этой причине, ряд антибиотиков, которые не используются для лечения инфекции, вызванной предполагаемым возбудителем, могут включаться в набор для определения чувствительности представителей некоторых определенных видов и родов.
2. Выбирать АМП, активные в отношении выделенного микроорганизма.
Определение чувствительности к антибиотикам, природно неактивным в отношении данного вида (группы) бактерий, не имеет терапевтического значения. Природная (врожденная) резистентность к АМП, в противовес приобретенной и/или мутационной резистентности, является свойством всех или почти всех изолятов бактериального вида. Примерами природной резистентности является резистентность представителей порядка Enterobacterales к гликопептидам и линезолиду, Proteus mirabilis – к нитрофурантоину и колистину, Serratia marcescens – к колистину, Stenotrophomonas maltophilia – к карбапенемам, грамположительных бактерий – к азтреонаму, энтерококков – к фузидиевой кислоте и т.д. Подробная информация о природной устойчивости доступна на сайте EUCAST в разделе «Expert rules and intrinsic resistance» (https://www.eucast.org/expert_rules_and_intrinsic_resistance).
3. Выбирать один антибиотик в качестве индикаторного.
Объединение антибиотиков в группы и классы основано, прежде всего, на их структурном сходстве и подобном механизме действия. Некоторые классы антибиотиков, такие как макролиды и линкозамиды, несмотря на различную химическую структуру, имеют одну и ту же мишень действия внутри бактериальной клетки и, таким образом, могут рассматриваться в свете интерпретации результатов определения чувствительности in vitro, как единая функциональная группа. Кроме того, в пределах некоторых групп АМП можно выделить подгруппы препаратов, в отношении которых бактерии проявляют полную перекрестную резистентность. Следовательно, результаты определения чувствительности могут и должны интерпретироваться для класса или группы антибиотиков, а не индивидуально для каждого препарата.
В этих случаях на практике достаточно оценивать чувствительность только к одному АМП данной группы. Такой препарат должен наилучшим образом выявлять механизм(ы), определяющий(ие) устойчивость возбудителя ко всем или большинству представителей этой группы, даже если он не применяется в терапевтических целях. Определение чувствительности in vitro к другим представителям данной группы не требуется, и более того, в отдельных случаях может привести к получению недостоверных результатов. Это объясняется плохой воспроизводимостью результатов при исследовании некоторых препаратов in vitro, и/или невозможностью провести надежную корреляцию между результатами определения чувствительности in vitro и клинической эффективностью.
Например, оксациллин и цефокситин, используются для выявления резистентности ко всем β-лактамам у стафилококков (MRSA), при этом для тестирования стафилококков in vitro не используется ни один другой β-лактамный антибиотик; оксациллин используется для скрининга резистентности к пенициллину у пневмококков; для скрининга наличия ESBL у энтеробактерий рекомендуется использовать как минимум два цефалоспорина.
Индикаторный препарат
представитель класса или группы антибиотиков, по результату определения чувствительности к которому можно с высокой степенью вероятности судить о чувствительности (резистентности) не только к данному препарату, но и к родственным антибиотикам.4. Учитывать дополнительную информацию.
При выборе АМП для тестирования необходимо учитывать информацию о типе инфекции (внебольничная или нозокомиальная), распространенности резистентных штаммов в стране, регионе и стационаре. Это позволит составить оптимальную панель АМП для определения чувствительности в каждом конкретном лечебном учреждении.
3.5.3.2 Перечень антибиотиков, рекомендованный для проведения эпидемиологического наблюдения за антибиотикорезистентностью приоритетных возбудителей
Предлагаемый перечень АМП может быть использован как при определении чувствительности с терапевтической целью, так и для проведения эпидемиологического наблюдения за АР. Данный перечень не является исчерпывающим. При появлении новых данных и новых АМП, а также в зависимости от локальных приоритетов, перечень может быть пересмотрен [43] .
Ниже указаны приоритетные для мониторинга АР препараты в зависимости от вида и/или группы микроорганизмов. В первом столбце («Определение чувствительности in vitro к препаратам») указаны приоритетные для мониторинга АР препараты, во втором столбце («Результат «Р» распространяется на препараты») указаны препараты/группы препаратов к которым с высокой степенью вероятности ожидается наличие резистентности (категория Р/R) при резистентности (категория Р/R) к препарату в первом столбце. Таким образом, используя для мониторинга АР указанные препараты из первого столбца можно прогнозировать (экстраполировать) наличие резистентности (категория Р/R) к другим препаратам. Если наименования препаратов в первом и втором столбце полностью совпадают, то наличие резистентности (категория Р/R) распространяется только на данный препарат (препараты из этого же класса следует оценивать отдельно). Следует отметить, что представленные таблицы составлены только для прогнозирования (экстраполяции) категории Р (R), экстраполяция категорий Ч (S) и УР (I) зависит от конкретных механизмов резистентности и их комбинаций, что требует отдельного рассмотрения каждого случая.
Enterobacterales
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Ампициллин или амоксициллин |
Аминопенициллины (ампициллин, амоксициллин), цефалоспорины I поколения
|
|
Амоксициллин/ клавулановая кислота |
Амоксициллин/клавулановая кислота, ампициллин/сульбактам
|
| Пиперациллин-тазобактам | Пиперациллин/тазобактам, амоксициллин/клавулановая кислота, ампициллин/сульбактам, цефоперазон-сульбактам |
| Цефотаксим или цефтриаксон |
Цефалоспорины III поколения (цефотаксим, цефтриаксон)
|
| Цефтазидим |
Цефтазидим
|
| Цефепим |
Цефепим
|
| Цефтазидим-авибактам |
Цефтазидим/авибактам
|
| Гентамицин или тобрамицин | Гентамицин, тобрамицин |
| Амикацин | Амикацин |
| Ципрофлоксацин или левофлоксацин |
Фторхинолоны (ципрофлоксацин, левофлоксацин, моксифлоксацин и др.)
|
| Пефлоксацин (ДДМ) скрининг |
Фторхинолоны (ципрофлоксацин, левофлоксацин, моксифлоксацин и др.)
|
| Имипенем | Имипенем |
| Меропенем |
Меропенем, дорипенем, эртапенем
|
| Эртапенем |
Эртапенем
|
| Колистин |
Полимиксины (колистин, полимиксин В)
|
| Фосфомицин |
Фосфомицин
|
| Нитрофурантоин |
Нитрофурантоин
|
P. aeruginosa
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Пиперациллин-тазобактам | Пиперациллин/тазобактам |
| Цефтазидим | Цефтазидим |
| Цефепим | Цефепим |
| Азтреонам | Азтреонам |
| Цефтолозан-тазобактам |
Цефтолозан/тазобактам
|
| Цефтазидим-авибактам |
Цефтазидим/авибактам
|
| Гентамицин или тобрамицин | Гентамицин, тобрамицин |
| Амикацин | Амикацин |
| Ципрофлоксацин или левофлоксацин | Фторхинолоны (ципрофлоксацин, левофлоксацин) |
| Имипенем | Имипенем |
| Меропенем | Меропенем, дорипенем |
| Колистин |
Полимиксины (колистин, полимиксин В)
|
Acinetobacter spp.
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Гентамицин или тобрамицин | Гентамицин, тобрамицин |
| Амикацин | Амикацин |
| Ципрофлоксацин или левофлоксацин | Фторхинолоны (ципрофлоксацин, левофлоксацин) |
| Имипенем | Имипенем |
| Меропенем | Меропенем |
| Колистин |
Полимиксины (колистин, полимиксин В)
|
|
Триметоприм/ сульфаметоксазол |
Триметоприм/сульфаметоксазол |
S. aureus
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
|
Цефокситин
(ДДМ) скрининг Оксациллин (МПК) скрининг |
Антистафилококковые бета-лактамы (оксациллин, амоксициллин/клавулановая кислота, ампициллин/сульбактам, цефазолин, цефуроксим, карбапенемы), кроме анти-MRSA цефемов (цефтаролин, цефтобипрол)
|
| Цефтаролин |
Цефтаролин
|
| Ципрофлоксацин или левофлоксацин или офлоксацин | Фторхинолоны (ципрофлоксацин, левофлоксацин, офлоксацин) |
| Норфлоксацин (ДДМ) скрининг | Скрининг резистентности к ципрофлоксацину, левофлоксацину, офлоксацину, моксифлоксацину |
| Ванкомицин |
Ванкомицин
|
| Линезолид | Линезолид |
| Рифампицин | Рифампицин |
| Эритромицин |
Макролиды (эритромицин, азитромицин, кларитромицин, рокситромицин и др.)
|
| Клиндамицин |
Клиндамицин, линкомицин, макролиды
|
| Гентамицин | Аминогликозиды |
S. pneumoniae
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
|
Оксациллин
(ДДМ) скрининг |
Первичный скрининг для выявления возможной резистентности к другим бета-лактамам (пенициллин, ампициллин, амоксициллина, амоксициллин/клавулановая кислота, ампициллин/сульбактам, пиперациллин, пиперациллин/тазобактам, цефотаксим, цефтриаксон, цефепим, цефтаролин, цефтобипрол, эртапенем, имипенем, меропенем) |
| Пенициллин (МПК) |
Пенициллин
|
| Цефотаксим или цефтриаксон |
Цефотаксим, цефтриаксон
|
| Цефтаролин |
Цефтаролин
|
| Эртапенем |
Эртапенем
|
| Эритромицин |
Макролиды (эритромицин, кларитромицин, азитромицин, рокситромицин и др.)
|
| Клиндамицин |
Клиндамицин, линкомицин, макролиды
|
| Левофлоксацин или моксифлоксацин | Левофлоксацин, моксифлоксацин |
| Норфлоксацин (ДДМ) скрининг | Скрининг резистентности к левофлоксацину, моксифлоксацину |
E. faecalis, E. faecium
| Определение чувствительности in vitro: | Результат «Р» распространяется на препараты: |
| Ампициллин или амоксициллин | Аминопенициллины (ампициллин, амоксициллин) |
| Гентамицин (высокая концентрация) скрининг |
Гентамицин
|
| Ципрофлоксацин или левофлоксацин |
Ципрофлоксацин, левофлоксацин
|
| Норфлоксацин (ДДМ) скрининг |
Скрининг резистентности к ципрофлоксацину, левофлоксацину
|
| Ванкомицин | Ванкомицин |
| Линезолид | Линезолид |
3.5.3.3 Стратегия интерпретации результатов определения чувствительности
Основой стратегии интерпретации результатов определения чувствительности является составление профиля чувствительности исследуемого образца не только на основании результатов изучения отдельных антибиотиков, но и механизмов резистентности, лежащих в его основе.
Стратегия состоит из трех этапов:
- Характеристика фенотипа резистентности на основании анализа полученных результатов исследований выбранного набора антибиотиков;
- Предположение о наличии определенного механизма резистентности на основе фенотипа;
- Прогнозирование фенотипа резистентности к другим антибиотикам, исходя из предполагаемого механизма резистентности.
Оптимальное выявление и характеристика фенотипа резистентности предполагает изучение минимального количества антибиотиков, принадлежащих к одному и тому же классу, в случае различных механизмов резистентности (например, аминогликозидов) или репрезентативных представителей большой группы (β-лактамы).
Наиболее полное и систематизированное описание данной стратегии представлено в документе Европейского комитета по определению чувствительности (EUCAST), известном под названием «Экспертные правила определения чувствительности к антибиотикам EUCAST» [44] .
3.6 Методы выявления механизмов резистентности, имеющих клиническое и эпидемиологическое значение
Выявление отдельных механизмов и детерминант (генетических маркеров) резистентности за исключением редких случаев (например, выявления mecA/mecC у стафилококков [45] ) не заменяет фенотипическое определение чувствительности, поскольку фенотип резистентности может быть связан с наличием множества различных генетических факторов, в том числе, неизвестных. Однако определение механизмов резистентности имеет важное значение, как для выбора и оптимизации АМТ у отдельных пациентов, так и для долгосрочного мониторинга антибиотикорезистентности [46] . Несмотря на кажущиеся различия, эти цели являются тесно взаимосвязанными, поскольку накопление регулярных (рутинных) данных о выявлении микроорганизмов с важными механизмами резистентности у отдельных пациентов со временем формирует пул эпидемиологических данных, которые, в свою очередь, позволяют оценивать риски и вероятность возникновения инфекций, вызванных «проблемными» резистентными возбудителями, и выбирать наиболее эффективные препараты, в том числе для эмпирического применения, у других пациентов (в отделении, стационаре, регионе, и т.д.).
В подавляющем большинстве случаев стандартные фенотипические методы позволяют проводить эффективную и комплексную оценку чувствительности к антибиотикам. Однако в отдельных случаях стандартные методы определения чувствительности к антибиотикам являются недостаточно эффективными или субоптимальными для выявления определенных механизмов и детерминант резистентности вследствие вариабельности их фенотипического проявления in vitro (например, устойчивости к карбапенемам у энтеробактерий, вызванной продукцией OXA-48), или являются длительными, трудоемкими либо недоступными (например, для выявления мутационной устойчивости микобактерий к различным препаратам [47] , или мутационной устойчивости патогенных для человека микоплазм к макролидам и фторхинолонам). В таких случаях выявление генетических маркеров резистентности является более эффективным или более доступным для предсказания АР.
В то же время определение конкретного механизма резистентности часто невозможно только на основании оценки профиля чувствительности, особенно в рутинной практике. Например, дифференциация мутационных (утрата/изменение поринов, активация эффлюкса) и ферментативных (продукция карбапенемаз) механизмов устойчивости к карбапенемам у Pseudomonas aeruginosa или Klebsiella pneumoniae является важной (как для выбора терапии, так и для определения эпидемиологической значимости), но может быть крайне затруднительной или невозможной на основании оценки антибиотикограммы (спектра и уровня устойчивости к антибиотикам). В связи с этим выявление наиболее важных механизмов и детерминант резистентности требует использования дополнительных методов, фенотипических или молекулярно-генетических [48] [49] [50] .
3.6.1 Основные механизмы и детерминанты резистентности подлежащие мониторингу
В настоящее время новые технологии, включая методы амплификации нуклеиновых кислот (МАНК) и секвенирования, становятся более доступными для практического использования в области клинической микробиологии благодаря техническому усовершенствованию, автоматизации и снижению стоимости. Эти методы позволяют осуществлять выявление любых известных детерминант (генов и мутаций), связанных с АР. Важным преимуществом МАНК является возможность быстрого определения детерминант резистентности не только у микробных изолятов, выделенных в чистой культуре, но и в образцах нативного биоматериала или положительных гемокультур. Однако с практической точки зрения наиболее важным является выявление отдельных механизмов, которые имеют особое клиническое и/или эпидемиологическое значение. Такие механизмы и методы их выявления подробно описаны в руководстве «The EUCAST guidelines for detection of resistance mechanisms and specific resistances of clinical and/or epidemiological importance» [51] , а также в руководствах Всемирной организации здравоохранения (ВОЗ) по использованию молекулярно-генетических методов и геномного секвенирования в системе мониторинга антибиотикорезистентности [52] [53] .
Для осуществления эффективного контроля за распространением инфекций и обеспечения рационального применения антибиотиков в стационаре наиболее важным является мониторинг следующих механизмов и детерминант резистентности:
- приобретенных карбапенемаз у Enterobacterales, P. aeruginosa и Acinetobacter;
- β-лактамаз расширенного спектра у Enterobacterales;
- mcr-опосредованной (плазмидно-кодируемой) резистентности к полимиксинам у Грам(-) бактерий;
- mecA/mecC-опосредованной резистентности к беталактамам у S. aureus;
- vanA/vanB-опосредованной резистентности к гликопептидам у E. faecium и E. faecalis.
Спектр выявляемых в каждой лаборатории механизмов и детерминант резистентности может отличаться и должен учитывать локальные, региональные и национальные данные о распространенности фенотипической резистентности и отдельных генетических маркеров. Он может изменяться и дополняться со временем в случае выявления новых значимых механизмов (например, в случае распространения штаммов стафилококков, устойчивых к оксазолидинонам, должен осуществляться мониторинг плазмидных Cfr рРНК метилтрансфераз).
3.6.1.1 Выявление приобретенных карбапенемаз у Enterobacterales, P. aeruginosa и Acinetobacter
Карбапенемазы – крайне разнородная группа бактериальных ферментов, относящихся к трем молекулярным классам A, B и D и множеству генетических групп, которые отличаются от других β-лактамаз способностью расщеплять карбапенемы. Продукция карбапенемаз является наиболее эффективным и эпидемиологически значимым механизмом резистентности к карбапенемам у Грам(-) бактерий [54] [55] . У Pseudomonas и Acinetobacter spp. наличие приобретенных карбапенемаз обычно коррелирует с фенотипической устойчивостью к карбапенемам, однако карбапенемазопродуцирующие энтеробактерии (CPE) могут проявлять «чувствительность» к меропенему и имипенему при тестировании in vitro в соответствии с клиническими пограничными значениями МПК и ДДМ для резистентных штаммов. С другой стороны, резистентность низкого уровня к карбапенемам у энтеробактерий может быть вызвана альтернативными механизмами, которые имеют меньшее клиническое и эпидемиологическое значение. При наличии результатов определения чувствительности выявление продукции карбапенемаз должно проводиться не только для резистентных штаммов, но для всех изолятов Enterobacterales с МПК меропенема >0,125 мг/л или диаметром зоны подавления роста вокруг диска с меропенемом (10 мкг) <28 мм. В стационарах с высоким уровнем распространенности СРЕ выявление продукции карбапенемаз может проводиться для всех изолятов энтеробактерий до получения данных о чувствительности к карбапенемам. При наличии у пациента факторов риска инфицирования СPE выявление генов карбапенемаз может также осуществляться с использованием амплификационных молекулярно-генетических методов (МАНК) в образцах нативного биоматериала или положительных гемокультур до выделения возбудителя в чистой культуре [56] .
Методы выявления карбапенемаз включают [57] :
- Методы определения чувствительности к карбапенемам и их комбинациям с различными ингибиторами («двойные», «комбинированные » диски или определение МПК в присутствии ингибиторов) – оценка синергизма. В связи с необходимостью использования различных ингибиторов и относительно низкой специфичностью данные методы в настоящее время имеют ограниченное применение.
- Иммунохроматографические методы. Позволяют выявлять продукцию и дифференцировать наиболее распространенные типы карбапенемаз у микробных изолятов.
- Методы оценки in vitro гидролиза карбапенемов с использованием индикаторного штамма (CIM, eCIM, mCIM), MALDI-ToF масс-спектрометрии, pH-индикаторов (Carba-NP тест и др.), флуорогенных карбапенемов (СarbaLux).
- МАНК (ПЦР-РВ и др.) и методы секвенирования.
Использование селективных и хромогенных сред позволяет осуществлять предварительный скрининг изолятов энтеробактерий с вероятной продукцией карбапенемаз, но не является специфическим методом выявления их продукции. Рост бактериальных изолятов на селективных средах, содержащих карбапенемы, может быть связан с наличием различных механизмов помимо продукции карбапенемаз. Наличие карбапенемаз должно быть подтверждено с помощью тестов, перечисленных выше. Многие неферментирующие бактерии (Acinetobacter, Pseudomonas и др.) способны расти на селективных средах, предназначенных для выявления CPE, в отсутствии приобретенных механизмов устойчивости к карбапенемам.
При использовании МАНК важно учитывать данные распространенности различных типов карбапенемаз, которые могут существенно отличаться для разных видов бактерий и разных географических регионов (Таблица 3.6.1.).
Таблица 3.6.1.1 Встречаемость различных карбапенемаз у Enterobacterales, P. aeruginosa и Acinetobacter spp. в России [55] [58] [59]
| Молекулярный тип карбапенемаз | Enterobacterales | P. aeruginosa | Acinetobacter spp. |
|---|---|---|---|
| VIM | + | ++++ | + |
| IMP | + | + | + |
| NDM | +++ | + | + |
| OXA-48 | ++++ | - | - |
| OXA-23 | - | - | ++++ |
| OXA-24/40 | - | - | ++++ |
| OXA-58 | - | - | ++ |
| KPC | ++ | - | - |
| GES-5 (G170S) 1 | - | +++ | - |
1 коммерческие тесты для дифференциации ESBL и карбапенемаз группы GES в настоящее время недоступны в России.
- ++++
- наиболее частый тип карбапенемаз
- +++
- широкое распространение
- ++
- распространение в отдельных стационарах и городах
- +
- единичные случаи
3.6.1.2 Выявление ESBL у Enterobacterales
β-Лактамазы расширенного спектра (ESBL) – ферменты, гидролизующие пенициллины, цефалоспорины I-IV поколения и азтреонам, но не гидролизующие цефамицины и карбапенемы. Большинство ESBL относятся к молекулярному классу А и подавляются «классическими» ингибиторами (клавулановой кислотой, сульбактамом, тазобактамом), а также авибактамом. Продукция ESBL встречается у всех клинически значимых видов энтеробактерий, как в стационарах, так и во внебольничной среде.
Методы выявления ESBL включают:
- Методы определения чувствительности к оксииминобеталактамам и их комбинациям с клавулановой кислотой («двойные», «комбинированные» диски или определение МПК в присутствии клавулановой кислоты – оценка синергизма).
- Методы оценки in vitro гидролиза оксииминобеталактамов с использованием индикаторного штамма (модифицированный CIM тест), MALDI-ToF масс-спектрометрии, pH-индикаторов.
- Иммунохроматографические методы. Позволяют выявлять продукцию и наиболее распространенных ESBL группы CTX-M у микробных изолятов.
- МАНК (ПЦР-РВ и др.) и методы секвенирования.
ESBL относятся к множеству различных генетических групп (семейств). Поэтому для универсальной детекции ESBL в основном используются фенотипические тесты, основанные на выявлении синергизма оксииминобеталактамов с клавулановой кислотой. Наиболее распространенными в настоящее время являются ферменты CTX-M-группы, которые, в свою очередь, делятся на генетические кластеры CTX-M-1-, CTX-M-2-, CTX-M-8/25- и CTX-M-9-родственных ферментов (самые частые варианты CTX-M-15, -3, -9 и -14 относятся к кластерам CTX-M-1 и CTX-M-9). Реже встречаются ESBL SHV-типа (SHV-2, -5, -12 и др.) которые представляют собой мутантные производные SHV пенициллиназ (SHV-1, -11 и др.) – видоспецифических ферментов K. pneumoniae. ESBL TEM-типа являются мутантными производными широко распространенных плазмидно кодируемых TEM пенициллиназ. В России ESBL TEM-типа встречаются крайне редко, несмотря на то, что пенициллиназы (TEM-1 и др.) присутствуют у подавляющего большинства клинических штаммов. Доступные в настоящее время в России диагностические тесты на основе МАНК позволяют выявлять только гены CTX-M ESBL, но не позволяют дифференцировать мутантные варианты SHV и TEM с расширенным спектром активности. Поэтому использование молекулярно-генетических методов не заменяет фенотипическое тестирование для обнаружения ESBL. Тем не менее, МАНК, включая ПЦР-РВ, могут применяться для быстрой детекции генов CTX-M β-лактамаз, например, в образцах нативного биоматериала и положительных гемокультур.
3.6.1.3 Выявление mcr-опосредованной резистентности к полимиксинам у Грам(-) бактерий
Гены mcr кодируют фосфоэтаноламин-трансферазы, ферменты, осуществляющие модификацию липида A – основного структурного компонента липополисахарида (ЛПС) и вызывающие устойчивость к полимиксинам. Гены mcr имеют плазмидную локализацию и могут распространяться горизонтально между различными штаммами и видами Грам(-) бактерий. В настоящее время описано множество генетических вариантов mcr, которые относятся как минимум к семи различным генетическим кластерам. Происхождение mcr связано с мобилизацией и переносом на плазмиды хромосомных генов Moraxella (mcr-1,-2), Aeromonas veronii (mcr-3), Shewanella (mcr-4) 23, Raoultella ornithinolytica (mcr-8) и Salmonella enterica ser. Typhimurium (mcr-9). Ген mcr-1, описанный первым, является наиболее распространенным у энтеробактерий, прежде всего, у штаммов E. coli, выделяемых от животных, человека и из окружающей среды. Распространенность плазмидных mcr среди клинических штаммов варьирует в разных странах и регионах, но обычно не превышает распространенность других механизмов резистентности к полимиксинам (модификации ЛПС, эффлюкса), связанных с мутациями в хромосомных генах. В связи с этим детекция mcr имеет в основном эпидемиологическое значение (из-за возможности горизонтального распространения).
Методы выявления mcr включают:
- МАНК (ПЦР-РВ и др.) и методы секвенирования.
- Иммунохроматографические методы. Позволяют выявлять экспрессию mcr-1 у микробных изолятов.
- Методы определения чувствительности к полимиксинам в присутсвии цинк-хелатирующих ингибиторов mcr (ЭДТА, дипиколиновой кислоты).
Другие методы, применяемые для ускоренной диагностики резистентности к полимиксинам, например, оценка роста на селективных средах или в присутствии pH индикаторов (polymyxin NP test), детекция модификаций липида А с помощью MALDI-ToF масс-спектрометрии (MALDIxin тест), не являются специфичными для mcr.
3.6.1.4 Выявление mecA/mecC-опосредованной резистентности к беталактамам у Staphylococcus aureus
Наличие гена mecA, который кодирует дополнительный пенициллин-связывающий белок (ПСБ2а/2’) с низкой аффинностью к беталактамам, является основным механизмом устойчивости Staphylococcus aureus и других видов стафилококков ко всем беталактамам (кроме цефтаролина и цефтобипрола). Помимо mecA штаммы S. aureus, проявляющие фенотип метициллинорезистентности (MRSA), выделяемые от животных и реже от человека, могут нести ген mecC, кодирующий альтернативный вариант ПСБ2а. Гены mecA и mecC входят в состав генетических элементов, известных как стафилококковые хромосомные кассеты mec (SCCmec), и часто ассоциированы с генами резистентности к другим антибиотикам. S. fleurettii и S. xylosus содержат видоспецифические гены ПСБ, гомологичные mecA и mecC. SCCmec элементы, несущие эти гены, также широко распространены у других видов стафилокков.
Методы выявления mecA/mecC-опосредованной резистентности включают:
- Определение МПК оксациллина или цефокситина, скрининг чувствительности к цефокситину с использованием ДДМ.
- МАНК (ПЦР-РВ и др.) и методы секвенирования.
- Латексная агглютинация. Позволяет выявлять ПСБ2a у микробных изолятов, выделенных в чистой культуре.
Выявление mecA/mecC с помощью МАНК является референтным методом детекции MRSA и метициллинорезистентности у других видов стафилококков (MRS) [60] [61] . Несмотря на то, что до настоящего времени в России не были выявлены штаммы, несущие ген mecC, для мониторинга MRSA рекомендуется использовать тесты, обеспечивающие возможность его детекции наряду с mecA. Важным при использовании МАНК для прямого выявления mecA/mecC в клинических образцах является также возможность определения вида возбудителя, который является их источником (S. aureus или другие стафилокки), особенно при анализе колонизации MRSA, поскольку коагулазонегативные стафилококки, колонизирующие кожу и верхние дыхательные пути, являются более частым источником mec генов.
3.6.1.5 Выявление vanA/vanB-опосредованной резистентности к гликопептидам у Enterococcus faecium и E. faecalis
Гены vanA и vanB являются основными детерминантами резистентности к гликопептидам (ванкомицину) у E. faecium и реже у E. faecalis. Они входят в состав мобильных генетических кластеров, которые кодируют синтез измененных мишеней – пептидных остатков (-D-аланил-D-лактат) с низкой аффинностью связывания ванкомицина. Другие редкие приобретенные гены vanD и vanE, а также видоспецифические гены vanC E. gallinarum, E. casseliflavus и E. flavescens имеют меньшее клиническое и эпидемиологическое значение.
Методы выявления vanA/vanB-опосредованной резистентности включают:
- Определение МПК ванкомицина.
- МАНК (ПЦР-РВ и др.) и методы секвенирования.
Распространенность устойчивости к ванкомицину, связанной с vanA/vanB, значительно отличается в разных странах. В России резистентность к ванкомицину в основном встречается у нозокомиальных штаммов E. faecium в стационарах онкологического и гематологического профиля и значительно реже в других стационарах. Мониторинг vanA и vanB является важным в случае увеличения частоты обнаружения ванкомицинорезистентных энтерококков (VRE).
Таблица 3.6.1.2 Основные механизмы устойчивости к антибактериальным препаратам
| Гены | Микроорганизмы | Вероятная устойчивость к… | Комментарий |
|---|---|---|---|
| *blaVIM | Pseudomonas spp., Enterobacterales | Пенициллины, ингибиторозащищенные пенициллины, цефалоспорины I-V, цефоперазон-сульбактам, цефепим-сульбактам, цефтолозан-тазобактам, цефтазидим-авибактам, карбапенемы | Реже могут встречаться у других грамотрицательных бактерий |
| *blaIMP | Pseudomonas spp. | Пенициллины, ингибиторозащищенные пенициллины, цефалоспорины I-V, цефоперазон-сульбактам, цефепим-сульбактам, цефтолозан-тазобактам, цефтазидим-авибактам, карбапенемы | Реже могут встречаться у других грамотрицательных бактерий |
| *blaNDM | Enterobacterales | Пенициллины, ингибиторозащищенные пенициллины, цефалоспорины I-V, цефоперазон-сульбактам, цефепим-сульбактам, цефтолозан-тазобактам, цефтазидим-авибактам, карбапенемы | Реже могут встречаться у других грамотрицательных бактерий |
| *blaOXA-48 | Enterobacterales | Пенициллины, ингибиторозащищенные пенициллины, карбапенемы | Значительно реже могут встречаться у других грамотрицательных бактерий |
| *blaOXA-23 | Acinetobacter spp. | Карбапенемы | В отдельных регионах описано распространение у Proteus spp. |
| *blaOXA-24/40 | Acinetobacter spp. | Карбапенемы | |
| *blaOXA-58 | Acinetobacter spp. | Карбапенемы | В отдельных регионах мира описано распространение у Proteus spp. |
| *blaKPC | Enterobacterales | Пенициллины, ингибиторозащищенные пенициллины, цефалоспорины I-V, цефоперазон-сульбактам, цефепим-сульбактам, цефтолозан-тазобактам, карбапенемы | В отдельных регионах мира описаны случаи распространения у Pseudomonas spp. |
| *blaGESCarb | Pseudomonas spp. | Пенициллины, цефалоспорины III-IV, азтреонам, карбапенемы | Важно! Необходима дифференциация от родственных генов, кодирующих ESBL (blaGESESBL) |
| *blaTEMESBL | Enterobacterales | Пенициллины, цефалоспорины I-V, азтреонам | Важно! Необходима дифференциация от родственных генов, кодирующих пенициллиназы (blaTEMPen ) |
| *blaSHVESBL | Enterobacterales | Пенициллины, цефалоспорины I-V, азтреонам | Важно! Необходима дифференциация от родственных генов, кодирующих пенициллиназы (blaSHVPen) |
| *blaCTX-M-1 | Enterobacterales | Пенициллины, цефалоспорины I-V, азтреонам | |
| *blaCTX-M-2 | Enterobacterales | Пенициллины, цефалоспорины I-V, азтреонам | |
| *blaCTX-M-9 | Enterobacterales | Пенициллины, цефалоспорины I-V, азтреонам | |
| *mcr-1 | Enterobacterales | Полимиксины | Реже могут встречаться у других грамотрицательных бактерий. Другие группы генов mcr распространены в меньшей степени, их регулярный эпидемиологический мониторинг важен только в тех регионах, где выявлены случаи распространения. |
| *armA | Enterobacterales | Все аминогликозиды | |
| *rmtB | Enterobacterales | Все аминогликозиды | |
| *rmtC | Enterobacterales | Все аминогликозиды | |
| *rmtF | Enterobacterales | Все аминогликозиды | |
| *mecA | Staphylococcus aureus* | Все беталактамы, кроме цефтаролина и цефтобипрола | Эпидемиологический мониторинг у других видов рода Staphylococcus не является обязательным |
| *mecC | Staphylococcus aureus | Все беталактамы, кроме цефтаролина и цефтобипрола | Эпидемиологический мониторинг у других видов рода Staphylococcus не является обязательным |
| *vanA | Enterococcus faecium, Enterococcus faecalis | Гликопептиды | Эпидемиологический мониторинг у других видов рода Enterococcus не является обязательным |
| *vanB | Enterococcus faecium, Enterococcus faecalis | Гликопептиды | Эпидемиологический мониторинг у других видов рода Enterococcus не является обязательным |
* Группа, включающая ряд родственных генов
3.6.2 Учет и регистрация данных выявления механизмов и детерминант резистентности
3.6.2.1 Номенклатура и стандартизация
Стандартизация записей результатов исследования является абсолютно необходимой для их обобщения и автоматического анализа. В различных источниках и базах данных для обозначения одних и тех же генетических детерминант резистентности могут использоваться разные названия. Например распространенный ген aadA1, кодирующий аминогликозид-аденилтрансферазу ANT(3’’)-Ia, может также обозначаться как aadA, aadA1-pm, или aad(3’’). В связи с этим для указания генетических маркеров устойчивости к АМП (генов и мутаций) рекомендуется использовать единую международно принятую номенклатуру и базы данных AMRFinderPlus или ResFinder/PointFinder [62] [63] .
Гены и кодируемые ими ферменты, как правило, обозначаются по-разному, например, гены группы blaVIM и кодируемые ими металло-β-лактамазы группы VIM. При учете результатов необходимо соблюдать единообразие записей.
3.6.2.2 Информативность результатов
Разные методы обеспечивают разную точность указания вариантов (типов) детерминант резистентности. В частности, ПЦР обычно позволяет выявить ген и установить его принадлежность к определенной группе, в то время как методы секвенирования позволяют установить точный вариант (например, группа blaOXA-48, тип blaOXA-244). В различных ситуациях точность указания группы или конкретного варианта гена или мутации могут иметь разное значение. Например, результат выявления гена «blaOXA» без указания группы или определенного варианта является неинформативным, поскольку это обозначение является общим для разных генов, кодирующих природные и приобретенные β-лактамазы класса D с разным спектром активности: пенициллиназы, цефалоспориназы и карбапенемазы. В то же время, указание наличия гена группы blaNDM является достаточным для определения металло-β-лактамазы, которая вызывает устойчивость к пенициллинам, цефалоспоринам и карбапенемам.
3.6.2.3 Организация записей
Результаты выявления одних и тех же механизмов или детерминант, полученные с использованием разных методов, например, ПЦР, секвенирования, фенотипических тестов, рекомендуется записывать отдельно (в разных столбцах таблицы или полях базы данных). Примеры учета результатов определения детерминант резистентности представлены в Таблице 3.6.2.
В случае если один тест позволяет выявлять и дифференцировать несколько детерминант (например, мультиплексная ПЦР для детекции генов разных карбапенемаз), рекомендуется учитывать результат обнаружения каждой из них отдельно. Результаты выявления и аннотации множества детерминант, полученные с помощью методов геномного секвенирования (WGS), могут быть записаны в виде одной строки с разделителями между названиями отдельных генов или мутаций.
Анализ механизмов резистентности обычно проводится не для всех, а для определенных или выборочных изолятов. В связи с этим учет отрицательных результатов тестов столь же важен, как и положительных. Учет отрицательных результатов позволяет впоследствии различать случаи, когда соответствующие детерминанты резистентности отсутствовали у микробных изолятов, и когда тестирование не производилось, и, таким образом, правильно оценивать истинную распространенность детерминант.
Выявление с помощью МАНК маркера резистентности непосредственно в клиническом образце из локуса, который в норме не является стерильным, не означает его обязательное наличие у микробного изолята, который может быть выделен из данного локуса. Например, одновременное обнаружение с помощью ПЦР генов группы blaOXA-48 и blaVIM в эндотрахеальном аспирате и последующее выделение в культуре изолятов K. pneumoniae и P. aeruginosa не позволяет констатировать факт наличия у каждого из этих изолятов генов двух карбапенемаз. Каждый выделенный изолят должен быть исследован на наличие карбапенемаз, и результаты представлены отдельно.
Таблица 3.6.2. Примеры учета результатов определения детерминант резистентности
| ID | Вид МО | ПЦР_NDM | ПЦР_VIM | ПЦР_IMP | ПЦР_OXA-48-гр. | ПЦР_KPC | CIM-тест | ESBL_ДД | WGS_генотип |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Klebsiella pneumoniae | Отр. | Отр. | Отр. | Положит. | Отр. | Положит. | Положит. | blaSHV-11|blaTEM-1|blaCTX-M-15|blaOXA-244|fosA|aadA2|qacEdelta1|sul1 |
| 2 | Pseudomonas aeruginosa | Отр. | Положит. | Отр. | Отр. | Отр. | Положит. | Нет данных | Нет данных |
| 3 | Escherichia coli | Отр. | Отр. | Отр. | Отр. | Отр. | Отр. | Положит. | Нет данных |