3.1 Базовые понятия
Микробная колонизация
это заселение участков кожи, слизистых оболочек и различных изделий медицинского назначения микроорганизмами, не сопровождающееся признаками и симптомами заболевания.Как правило, происходит колонизация тканей организма, которые находятся в контакте с внешней средой (слизистые оболочки мочеполового и пищеварительного тракта, дыхательных путей, кожа и конъюнктива). Микроорганизмы, колонизирующие эти области, имеют различные механизмы адгезии, способны преодолевать и выдерживать постоянное сопротивление защитных механизмов макроорганизма, таким образом, находясь с последним в состоянии динамического равновесия без причинения вреда в данный момент времени.
Инфекция
это инвазия и размножение чужеродных агентов в организме хозяина, приводящие к патологическому состоянию или заболеванию.В результате инфекции, т.е. проникновения чужеродного агента в организм хозяина, размножения в нем, высвобождения продуктов метаболизма (ферменты, эндо- и экзотоксины) нарушаются нормальные физиологические процессы, постоянство внутренней среды (гомеостаз) в организме хозяина. Это приводит к мобилизации неспецифических и специфических механизмов защиты, направленных на уменьшение или ликвидацию чужеродного агента с целью компенсации повреждения.
Почему для задач мониторинга АР важно различать колонизацию и инфекцию?
С точки зрения мониторинга АР принципиально важным является разделение всех выделенных от пациента микроорганизмов на:
- клинически значимые изоляты, т.е. изоляты являющиеся причиной инфекционного процесса конкретной локализации (например, S. pneumoniae при инфекциях нижних дыхательных путей, E. coli при глубоких инфекциях в области хирургического вмешательства);
- колонизирующие, т.е. микроорганизмы не являющиеся причиной инфекции конкретной локализации (например, зеленящие стрептококки в ротовой полости, S. epidermidis на поверхности кожи; E. coli на поверхности мочевого катетера при отсутствии симптомов инфекции мочевыводящих путей; микроорганизмы, выделенные из нестерильных локусов при исследовании на носительство). Следует отметить, что при наличии определенных условий (входные ворота инфекции, ослабленный иммунный статус и т.п.), колонизирующий изолят способен вызвать инфекционный процесс, т.е. стать клинически значимым.
Клинически значимые изоляты в действительности отражают этиологическую структуру с соответствующим профилем резистентности для конкретной нозологии (т.е. при уже совершившемся случае инфекции). В свою очередь, колонизирующие изоляты отражают состояние микробиоты (с характерным профилем резистентности) и представляют потенциальных возбудителей инфекций (однако сам случай инфекции отсутствует). Данная классификация является условной. С точки зрения оценки трендов АР и последующего составления локальных протоколов по антимикробной терапии наибольшую ценность представляют клинически значимые изоляты.
Следует обратить внимание, что для отдельных категорий пациентов (например, новорожденные дети, онкогематологические и иммунокомпрометированные пациенты) колонизирующие изоляты имеют особое значение, т.к. с большей вероятностью (в силу особенностей статуса макроорганизма) могут стать этиологическим агентом при наступлении случая инфекции.
С понятием «клинически значимые» изоляты неразрывно связано определение случая инфекции.
Что такое эпидемиологическое определение случая инфекции?
Эпидемиологическое определение случая инфекции
это набор стандартных критериев для выявления у пациента определенного заболевания, синдрома или другого состояния с целью эпидемиологического надзора.Использование согласованного стандартного определения случая инфекции гарантирует, что все случаи эквивалентны, независимо от времени и места их идентификации, что обеспечивает сопоставимость данных. Стандартные эпидемиологические определения случаев инфекции представлены в приложении 6.5.
Что такое нозокомиальные инфекции и в чем заключается важность определения случая нозокомиальной инфекции с точки зрения мониторинга АР?
Согласно формальному определению ВОЗ, нозокомиальная инфекция (НИ)
это любое клинически распознаваемое инфекционное заболевание, которое развивается у пациента не менее чем через 48 часов после госпитализации (и не находившееся в инкубационном периоде на момент госпитализации), в течение 3 дней после выписки или 30 дней после операции (до 1 года – при наличии имплантатов), а также любое инфекционное заболевание сотрудника стационара, развившееся вследствие его работы в данном учреждении, вне зависимости от времени появления симптомов.Наиболее распространенными являются следующие типы НИ: инфекции нижних дыхательных путей, инфекции мочевыводящих путей, инфекции в области хирургического вмешательства, инфекции кровотока.
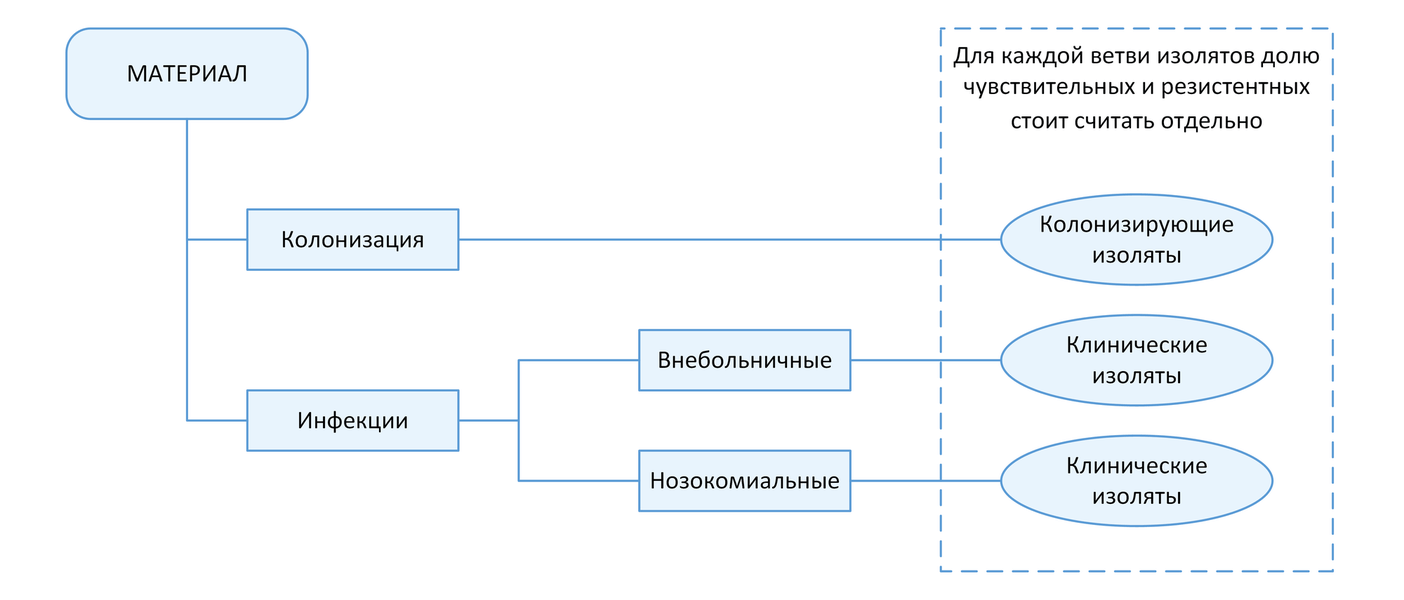
С точки зрения мониторинга АР принципиально важным является разделение инфекций на два типа: нозокомиальные и внебольничные (т.е. не удовлетворяющие критериям нозокомиальных). Данное разделение необходимо, так как для внебольничных и нозокомиальных инфекций одних и тех же локализаций существуют значимые различия в этиологической структуре и профиле резистентности возбудителей. Поэтому при статистической обработке данных необходимо производить расчеты показателей (частоты встречаемости возбудителя, относительное количество резистентных изолятов и т.п.) отдельно для каждого типа инфекций (Рисунок 1).
Какие микроорганизмы являются приоритетными для мониторинга АР?
Согласно рекомендациям ВОЗ (Cистема эпиднадзора за устойчивостью к противомикробным препаратам в Центральной Азии и Восточной Европе, 2019 г.) первоочередной интерес для мониторинга АР представляют девять видов (групп) микроорганизмов [27] :
- Escherichia coli (E. coli);
- Klebsiella pneumoniae (K. pneumoniae);
- Salmonella spp.;
- Pseudomonas aeruginosa (P. aeruginosa);
- Acinetobacter spp.;
- Staphylococcus aureus (S. aureus);
- Streptococcus pneumoniae (S. pneumoniae);
- Enterococcus faecalis (E. faecalis);
- Enterococcus faecium (E. faecium).
В качестве ориентира для формирования списка приоритетных для мониторинга АР возбудителей в РФ можно также использовать данные AMRmap (https://amrmap.ru система мониторинга АР национального уровня). Частота встречаемости различных возбудителей внебольничных и нозокомиальных инфекций в РФ (согласно данным AMRmap) представлена в таблице 3.1.1. Возбудители частота встречаемости которых не превышает 2% в таблицу не включены.
Таблица 3.1.1. Частота встречаемости различных видов микроорганизмов при внебольничных и нозокомиальных инфекция в РФ согласно данным AMRmap
| Вид | Абсолютная частота (N) | Относительная частота (%) |
|---|---|---|
| Нозокомиальные | ||
| Pseudomonas aeruginosa | 5049 | 19.31 |
| Klebsiella pneumoniae | 4975 | 19.02 |
| Acinetobacter baumannii | 3583 | 13.7 |
| Staphylococcus aureus | 3378 | 12.92 |
| Escherichia coli | 3187 | 12.19 |
| Enterococcus faecalis | 1005 | 3.84 |
| Enterobacter cloacae | 744 | 2.85 |
| Proteus mirabilis | 696 | 2.66 |
| Stenotrophomonas maltophilia | 616 | 2.36 |
| Enterococcus faecium | 603 | 2.31 |
| Serratia marcescens | 528 | 2.02 |
| Внебольничные | ||
| Escherichia coli | 3633 | 22.43 |
| Streptococcus pneumoniae | 2916 | 18.01 |
| Staphylococcus aureus | 2293 | 14.16 |
| Streptococcus pyogenes | 2262 | 13.97 |
| Haemophilus influenzae | 1105 | 6.82 |
| Klebsiella pneumoniae | 925 | 5.71 |
| Neisseria gonorrhoeae | 679 | 4.19 |
| Pseudomonas aeruginosa | 472 | 2.91 |
| Enterococcus faecalis | 335 | 2.07 |
Следует отметить, что при налаженном процессе локального мониторинга АР не представляет сложности расширить предложенный список микроорганизмов. Более того, включение всех выделяемых видов микроорганизмов в процесс мониторинга АР (учитывая тип инфекции и колонизацию) является предпочтительным, т.к. позволяет получить полное представление о локальной эпидемиологии АР.
Какое количество изолятов является репрезентативным для мониторинга АР?
В рамках мониторинга АР осуществляется расчет различных показателей, как правило выраженных в абсолютных и относительных частотах. Например, расчет и оценка доли (%) конкретного микроорганизма в этиологической структуре возбудителей инфекций или оценка доли резистентных изолятов. Ввиду различного объема выборки (количества изолятов) степень уверенности в достоверности полученных показателей может быть различной. Для объективной оценки степени уверенности (доверия) в полученных данных существует специальный показатель – доверительный интервал (ДИ). Наиболее часто используемым ДИ в биомедицинских исследованиях является 95%-ый ДИ [28] . Он представлен в виде интервальных значений, например, 50% резистентных изолятов (95%-ый ДИ: 30–70%). Доверительный интервал (95%-ый ДИ), означает, что при повторном проведении 100 исследований с таким же дизайном истинное значение оцениваемого показателя (в данном примере доли резистентных изолятов) в 95 исследованиях из 100 будет находиться в пределах указанной ширины интервала (в данном примере ширина – от 30 до 70%). Таким образом, в указанном примере несмотря на оценку доли резистентных изолятов в 50%, истинная доля может находиться в пределах 30–70%.
ДИ напрямую связан с объемом выборки (количеством изолятов): чем больше объем выборки (количество изолятов), тем меньше ширина ДИ (т.е. большая точность оценки), и наоборот. ДИ рассчитывается с помощью специальных формул. Однако для приблизительной оценки необходимого объема выборки (точности оценки) можно ориентрироваться на значения, представленные в таблице 3.1.2.
Таблица 3.1.2. Ширина 95%-ого ДИ в зависимости от объема выборки
| Объем выборки (количество изолятов) | Ширина 95%-ого ДИ (в %) |
|---|---|
| 20 | ± 20,07 |
| 40 | ± 14,08 |
| 80 | ± 10,70 |
| 100 | ± 6,86 |
| 200 | ± 4,88 |
| 300 | ± 3,99 |
| 500 | ± 3,09 |
Исходя из таблицы 3.1.2., при выборке в 20 изолятов истинное значение доли резистентных изолятов будет находиться в пределах ± 20,07%. Например, если 10 из 20 (т.е. 50%) протестированных изолятов резистентны к конкретному антимикробному препарату, то истинное значение доли резистентных изолятов будет находиться в пределах 50 ± 20,07%. Такой же принцип действителен при оценке этиологической структуры. Например, при инфекциях конкретной локализации идентифицировано 80 изолятов из них 40 изолятов (50%) составляет Klebsiella pneumoniae, используя таблицу 3.1.2. можно приблизительно оценить истинное значение доли Klebsiella pneumoniae в общей структуре (50 ± 10,70%).
Следует отметить, что наряду с использованием ширины 95%-ого ДИ для вероятностной оценки точности и необходимого количества изолятов, с целью формирования репрезентативной выборки необходимо также учитывать «смещающие» факторы (например, включение в исследование только изолятов резистентных к конкретному АМП или включение дублей и повторных изолятов, см. раздел 4.3.).
Изменено 15 января 2024